
【題目】已知反應:CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g)。在一定壓強下,按ω=
CH2=CHCH2Cl(g)+HCl(g)。在一定壓強下,按ω=![]() 向密閉容器中充入氯氣與丙烯。圖甲表示平衡時,丙烯的體積分數(
向密閉容器中充入氯氣與丙烯。圖甲表示平衡時,丙烯的體積分數(![]() )與溫度(T)、ω的關系,圖乙表示反應的平衡常數K與溫度T的關系。則下列說法正確的是( )
)與溫度(T)、ω的關系,圖乙表示反應的平衡常數K與溫度T的關系。則下列說法正確的是( )

A.圖甲中ω1>1
B.圖乙中,線A表示正反應的平衡常數
C.在恒容容器中進行,壓強不變時反應達到平衡狀態
D.當溫度為T1、ω=2時,Cl2的轉化率約為33.3%
【答案】D
【解析】
A.增大氯氣的濃度,平衡向正反應方向移動,丙烯的體積分數減小,由圖可知,丙烯的體積分數ω1大于ω2,則ω1<1,故A錯誤;
B.由圖甲可知,溫度升高,丙烯的體積分數增大,說明平衡向逆反應方向移動,該反應為放熱反應,升高溫度,放熱反應的平衡常數減小,則圖乙中,線B表示正反應的平衡常數,故B錯誤;
C.該反應是一個氣體體積不變的可逆反應,無論是否達到平衡,壓強始終不變,則在恒容容器中進行,壓強不變時不能說明反應達到平衡狀態,故C錯誤;
D.設溫度為T1、ω=2時,容器體積為1L,CH2=CHCH3的起始物質的量為1mol,消耗物質的量為xmol,由題意建立如下三段式:
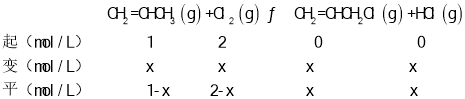
由平衡常數K=1可得![]() =1,解得x=
=1,解得x=![]() ,則Cl2的轉化率為
,則Cl2的轉化率為![]() ≈33.3%,故D正確;
≈33.3%,故D正確;
故選D。


 中考利劍中考試卷匯編系列答案
中考利劍中考試卷匯編系列答案科目:高中化學 來源: 題型:
【題目】I.由四種常見元素組成的化合物X,按如下流程進行實驗。氣體C能使帶火星木條復燃,溶液B和溶液E的焰色反應為黃色,固體A和D組成元素相同。
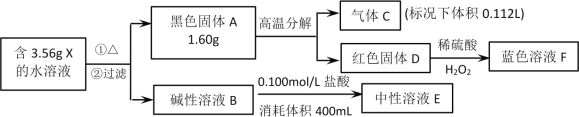
請回答:
(1)X 的化學式__________________。
(2)X可由藍色溶液F與過量的濃的B溶液反應獲得,寫出該反應的離子方程式_____________。
(3)黑色固體A可在高溫下與氨氣作用生成紅色固體D,同時生成一種單質,寫出該反應的方程式________________________________________。
II.為測定碳酸鈉和碳酸氫鈉混合樣品中碳酸鈉的質量分數,可通過加熱分解得到的CO2質量進行計算。某同學設計的實驗裝置示意圖如下:
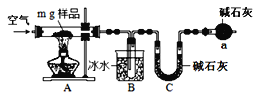
請回答:
(1)儀器a的作用是________________________________________。
(2)指出該同學設計的實驗裝置存在的缺陷__________________________________。
(3)設計實驗方案說明樣品中碳酸氫鈉已經分解完全_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】堿式氯化銅為綠色或墨綠色結晶性粉末,難溶于水,溶于稀酸和氨水,在空氣中十分穩定。
Ⅰ.模擬制備堿式氯化銅。向![]() 溶液中通入
溶液中通入![]() 和
和![]() ,調節pH至5.0~5.5,控制反應溫度于70~80℃,實驗裝置如圖所示(部分夾持裝置已省略)。
,調節pH至5.0~5.5,控制反應溫度于70~80℃,實驗裝置如圖所示(部分夾持裝置已省略)。
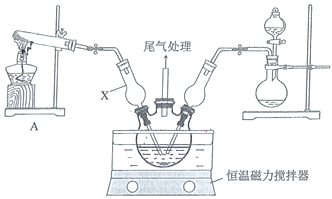
(1)儀器X的名稱是________,其主要作用有導氣、________。
(2)實驗室利用裝置A制![]() ,發生反應的化學方程式為________。
,發生反應的化學方程式為________。
(3)反應過程中,在三頸燒瓶內除觀察到溶液藍綠色褪去,還可能觀察到的現象是________、________、________。
(4)若體系![]() 過高會導致堿式氯化銅的產量_______(填“偏高”、“偏低”或“無影響”)。
過高會導致堿式氯化銅的產量_______(填“偏高”、“偏低”或“無影響”)。
(5)反應結束后,將三頸瓶中的混合物過濾,從濾液中還可以獲得的副產品是________(填化學式),經提純得產品無水堿式氯化銅。
Ⅱ.無水堿式氯化銅組成的測定。稱取產品![]() ,加硝酸溶解,并加水定容至200mL,得到待測液。
,加硝酸溶解,并加水定容至200mL,得到待測液。
(6)銅的測定:取20.00mL測液,經測定,![]() 濃為
濃為![]() 。則稱取的樣品中
。則稱取的樣品中![]() ________mol。
________mol。
(7)采用沉淀滴定法測定氯:用![]() 標準溶液滴定過量的
標準溶液滴定過量的![]() ,實驗如圖:
,實驗如圖:

①滴定時,應選用下列哪種物質作為指示劑________(填標號)。
A.![]() B.
B.![]() C.
C.![]()
②重復實驗操作三次,消耗![]() 溶液的體積平均為10.00mL。則稱取的樣品中
溶液的體積平均為10.00mL。則稱取的樣品中![]() ______mol。
______mol。
(8)根據上述實驗結果可推知無水堿式氯化銅的化學式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國中草藥文化源遠流長,通過臨床試驗,從某中草藥中提取的有機物具有較好的治療癌癥的作用,該有機物的結構如圖所示。下列說法中錯誤的是( )

A.分子式為C13H12O6
B.該有機物能發生取代反應、加成反應、氧化反應
C.1mol該有機物與NaOH反應最多消耗2molNaOH
D.1mol該有機物與溴水反應最多消耗3molBr2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】輝銅礦(主要成分是Cu2S)含銅量高,是最重要的煉銅礦石。請回答下列問題:
Ⅰ.已知:①2Cu2S(s)+3O2(g) ![]() 2Cu2O(s)+2SO2(g) ΔH=768.2kJ·mol1
2Cu2O(s)+2SO2(g) ΔH=768.2kJ·mol1
②Cu2S(s)+O2(g)![]() 2Cu(s)+SO2(g) ΔH=217.4 kJ·mol1
2Cu(s)+SO2(g) ΔH=217.4 kJ·mol1
(1)Cu2S與Cu2O反應生成Cu和SO2的熱化學方程式為____________,該反應中Cu2O作_________(填“氧化劑”或“還原劑”)。
Ⅱ.Cu2O可催化二甲醚合成乙醇。
反應①:CH3OCH3(g)+CO(g)![]() CH3COOCH3(g) ΔH1
CH3COOCH3(g) ΔH1
反應②:CH3COOCH3(g)+2H2(g)![]() CH3OH(g)+C2H5OH(g) ΔH2
CH3OH(g)+C2H5OH(g) ΔH2
(2)壓強為p kPa時,同一體系中發生反應①和反應②,溫度對二甲醚(CH3OCH3)和乙酸甲酯(CH3COOCH3)平衡轉化率的影響如圖1所示,則ΔH1______0(填“>”或“<”,下同)、ΔH2______0。溫度對平衡體系中乙酸甲酯的百分含量和乙醇的百分含量的影響如圖2所示。在300~600 K范圍內,乙酸甲酯的百分含量逐漸增大,而乙醇的百分含量逐漸減小的原因是____________。
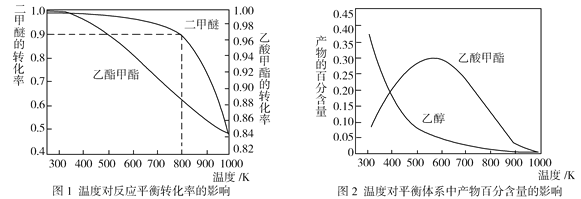
(3)若壓強為p kPa、溫度為800 K時,向2 L恒容密閉容器中充入1 mol CH3OCH3和1 mol CO發生反應①,2min時達到平衡,則前2min內CH3COOCH3的平均生成速率為_________,該條件下平衡常數K=_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙醇是一種重要的化工原料,由乙醇為原料衍生出的部分化工產品如圖所示:
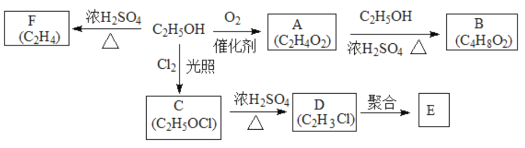
(1)A的結構簡式為______。
(2)由A生成B的化學方程式為______。
(3)由乙醇生成C的反應類型為______。
(4)D中官能團名稱是氯原子和______。
(5)由F生成乙醇的化學方程式為______。
(6)E的結構簡式為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酰氯(NOC1)是一種黃色氣體,沸點為-5.5℃。其液體呈紅褐色。遇水發生反應:2NOC1+H2O=2HC1+NO↑+NO2↑。某化學興趣小組設計如圖裝置用C12和NO制備NOC1。回答下列相關問題:
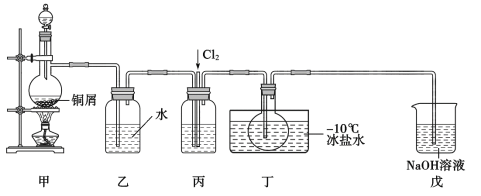
(1)甲裝置發生的離子反應方程式為__,裝置丙中的液體為__。
(2)實驗時,先通入Cl2,待丁中燒瓶內充滿黃綠色氣體時,再通入NO,這樣做的目的是__。
(3)裝置丁中冰鹽水的作用是__。
(4)經分析該套裝置設計上有一處明顯缺陷,改進方法是__(用文字描述)。
(5)吸收尾氣時,NOCl發生反應的化學方程式為__。
(已知:NO+NO2+2NaOH=2NaNO2+H2O)
(6)反應完成后,取燒瓶中所得產物mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液為指示劑,用cmol·L-1AgNO3標準溶液滴定至終點,消耗標準溶液的體積為VmL。則產物中NOCl純度的計算式為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2018年國際計量大會將“摩爾”的定義修改為:1摩爾包含6.02214076×1023個基本單元,這一常數被稱為阿伏加德羅常數(NA),通常用6.02×1023 mol-1表示,新定義于2019年5月20日正式生效。下列說法不正確的是
A.標準狀況下,22.4L的NH3約含有10×6.02×1023個質子
B.由新定義可知,阿伏加德羅常數表達為NA=6.02214076×1023 mol-1
C.標準狀況下,18gH2O中約含有1×6.02×1023個氧原子
D.白磷分子(P4)呈正四面體結構,62g白磷中約含有12×6.02×1023個P-P鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上可用甲苯合成苯甲醛:
 ,
,
下列說法正確的是
A. 甲苯分子中所有原子都在同一平面內 B. 反應①②③的反應類型相同
C. 一氯甲苯的同分異構體有3種 D. 苯甲醇可與金屬鈉反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com