
海底蘊藏著大量的“可燃冰”。用甲烷制水煤氣(CO、H2),再合成甲醇來代替日益供應緊張的燃油。
已知:① CH4(g)+H2O (g)=CO (g)+3H2 (g) △H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g)
△H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g)
△H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2 (g) △H3=+165.0 kJ·mol-1
(1)CH4(g)與CO2 (g)反應生成CO(g)和H2(g)的熱化學方程式為 。
(2)從原料、能源利用的角度,分析反應②作為合成甲醇更適宜方法的原因是 。
(3)水煤氣中的H2可用于生產NH3,在進入合成塔前常用[Cu(NH3)2]Ac溶液來吸收其中的CO,防止合成塔中的催化劑中毒,其反應是: [Cu(NH3)2]Ac
+ CO + NH3  [Cu(NH3)3]Ac·CO
△H<0
[Cu(NH3)3]Ac·CO
△H<0
[Cu(NH3)2]Ac溶液吸收CO的適宜生產條件應是 。
(4)將CH4設計成燃料電池,其利用率更高,裝置示意如下圖(A、B為多孔性石墨棒)。持續通入甲烷,在標準狀況下,消耗甲烷體積VL。0<V≤44.8 L時,電池總反應方程式為 。
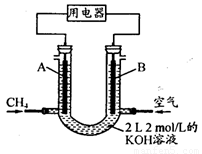
② 44.8 L<V≤89.6 L時,負極電極反應為 。
③ V=67.2 L時,溶液中離子濃度大小關系為 。
(1)CH4 (g)+CO2 (g) =2CO (g)+2H2 (g) △H=+247.4 kJ·mol-1(2)反應②是放熱反應,可節省能源;同時制得的CO與H2物質的量之比為1:2,能恰好反應合成甲醇,符合綠色化學的“原子經濟”原則。(3)低溫、高壓(4) ①CH4 + 2O2 + 2KOH =K2CO3 + 3H2O ②CH4—8e-+ 9CO32-+3H2O =10HCO3-③c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
【解析】
試題分析:(1)根據蓋斯定律可知,①×2-③可得CH4(g)+CO2(g)=2CO(g)+2H2(g),所以其△H=[(+206.2)×2-(+165.0)]kJ•mol-1=+247.4 kJ•mol-1,所以CH4(g)與CO2(g)反應生成CO(g)和H2(g)的熱化學方程式為CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4 kJ•mol-1 (2)從能量角度比較,①是吸熱反應,需要消耗更多能量,②是放熱反應,不需要太多能量;從原子利用率角度,由于CO+2H2→CH3OH,①的產物中氫原子不可能全部變為CH3OH,而②的產物中所有原子都可能全部變為CH3OH;因此選②,甲烷不完全燃燒制合成氣時放出熱量,還得到物質的量之比為1:2的CO和H2的混合氣體,能恰好完全反應生成甲醇(3)已知正反應是氣態物質體積減小的放熱反應,因此采用降低溫度、增大壓強能使平衡右移,提高CO的轉化率,故答案為:低溫、高壓(4)(4)n(KOH)=2mol/L×2L=4mol,可能先后發生反應①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;①當0<V≤44.8 L時,0<n(CH4)≤2mol,則0<n(CO2)≤2mol,只發生反應①②,且KOH過量,則電池總反應式為CH4+2O2+2KOH=K2CO3+3H2O,故答案為:CH4+2O2+2KOH=K2CO3+3H2O;②當44.8 L<V≤89.6 L,2mol<n(CH4)≤4mol,則2mol<n(CO2)≤4mol,發生反應①②③,得到K2CO3和KHCO3溶液,則負極反應式為CH4-8e-+9CO32-+3H2O=10HCO3-,故答案為:CH4-8e-+9CO32-+3H2O=10 HCO3-;③當V=67.2 L時,n(CH4)=3mol,n(CO2)=3mol,則電池總反應式為3CH4+6O2+4KOH=K2CO3+2KHCO3+7H2O,則得到1molK2CO3和2molKHCO3的溶液,則c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案為:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
考點:用蓋斯定律進行有關反應熱的計算;化學電源新型電池


科目:高中化學 來源: 題型:013
下列說法中不正確的是
[ ]
A.海水中溶解有多種化學元素,常被稱為“液體礦山”
B.海底蘊藏著大量的錳結核礦,它是淺褐色至黑色的結核狀礦物體
C.波浪能、潮汐能和海流能均屬于海洋能源,可作新能源開發作用
D.從海水中可以提取人類生活所必需的任何用品
查看答案和解析>>
科目:高中化學 來源: 題型:
(1)下列有關“可燃冰”的敘述中不正確的是( )
A.“可燃冰”也可能成為人類未來的重要能源
B.“可燃冰”是一種比較潔凈的能源
C.“可燃冰”為水可能變成油提供了有利的證據
D.“可燃冰”的主要可燃成分是甲烷
(2)“可燃冰”的平均組成可用下列的化學式表示( )
A.3CH4·H2O B.CH4·3H2O C.CH4·6H2O D.CH4·8H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
第28屆國際地質大會提供的資料顯示,海底蘊藏著大量的天然氣水合物,俗稱“可燃冰”,1體積“可燃冰”可貯藏100—200體積的天然氣。“可燃冰”是一種晶體,晶體中平均每46個H2O分子構建成8個籠,每個籠內可容納1個CH4分子或1個游離的H2O分子。若晶體中每8個籠有6個容納了CH4分子,另外2個籠被游離的H2O分子填充,請根據上述信息完成下面試題。
13.下列有關“可燃冰”的敘述中不正確的是( )
A.“可燃冰”也可能成為人類未來的重要能源
B.“可燃冰”是一種比較潔凈的能源
C.“可燃冰”為水可能變成油提供了有利的證據
D.“可燃冰”的主要可燃成分是甲烷
14.“可燃冰”的平均組成可用下列的化學式表示( )
A.3CH4·H2O B.CH4·3H2O C.CH4·6H2O D.CH4·8H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
第28屆國際地質大會提供的資料顯示,海底蘊藏著大量的天然氣水合物,俗稱“可燃冰”,1體積“可燃冰”可貯藏100~200體積的天然氣。“可燃冰”是一種晶體,晶體中平均每46個H2O分子構建成8個籠,每個籠內可容納1個CH4分子或1個游離的H2O分子。若晶體中每8個籠有6個容納了CH4分子,另外2個籠被游離的H2O分子填充,“可燃冰”的平均組成可用下列的化學式表示
A.3CH4?H2O B.CH4?3H2O C.CH4?6H2O D.CH4?8H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com