
【題目】在室溫下,下列敘述正確的是
A.將1mL1.0×10-5mol/L鹽酸稀釋到1000mL,溶液的pH=8
B.用pH=1的鹽酸分別中和1mL pH=13的NaOH溶液和氨水,NaOH消耗鹽酸的體積大
C.pH=2的鹽酸與pH=1的硫酸比較,c(Cl-)=c(SO42-)
D.室溫下,向0.20 mol/L NH4HCO3中通入CO2至溶液呈中性:c(NH4+)=c(HCO3—)+2c(CO32—)
【答案】D
【解析】
A. 鹽酸稀釋后還是酸,溶液的pH始終小于7;
B. NaOH是強堿,氨水是弱堿,pH相同的NaOH和氨水,溶液濃度氨水>NaOH,;堿的濃度越大,消耗鹽酸越多;
C. pH=2的鹽酸中c(H+)=c(Cl-)=0.01mol/L,pH=1的硫酸中c(SO42-)=![]() c(H+)=0.05mol/L;
c(H+)=0.05mol/L;
D. 溶液呈中性,有c (H+)= c (OH-),溶液中存在電荷守恒,根據電荷守恒進行判斷;
A. 鹽酸稀釋后還是酸,溶液的pH始終小于7,不可能變成8,A項錯誤;
B. NaOH是強堿,氨水是弱堿,pH相同的NaOH和氨水,溶液濃度氨水>NaOH,;堿的濃度越大,消耗鹽酸越多,因此氨水消耗的鹽酸更多,B項錯誤;
C. pH=2的鹽酸中c(H+)=c(Cl-)=0.01mol/L,pH=1的硫酸中c(SO42-)=![]() c(H+)=0.05mol/L,因此c(Cl-)<c(SO42-),C項錯誤;
c(H+)=0.05mol/L,因此c(Cl-)<c(SO42-),C項錯誤;
D. 根據電荷守恒可知c (H+)+ c (NH4+)=c (OH-)+c (HCO3-)+2c (CO32-),溶液呈中性,有c (H+)= c (OH-),因此c (NH4+)=c (HCO3-)+2c (CO32-),D項正確;
答案選D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】海洋資源的開發與利用具有廣闊的前景。海水的pH一般在7.5~8.6之間。某地海水中主要離子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mgL-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(1)海水顯弱堿性的原因是(用離子方程式表示):____________,該海水中Ca2+的物質的量濃度為__________mol/L 。
(2)電滲析法是近年發展起來的一種較好的海水淡化技術,其原理如下圖所示。其中陰(陽)離子交換膜只允許陰(陽)離子通過,電極均為惰性電極。

① 開始時陽極的電極反應式為________________。
② 電解一段時間,____極(填“陰”或“陽”)會產生水垢,其成份為_____(填化學式)。
③ 淡水的出口為a、b、c中的__________出口。
(3)海水中鋰元素儲量非常豐富,從海水中提取鋰的研究極具潛力。鋰是制造化學電源的重要原料,如LiFePO4電池某電極的工作原理如圖所示:

該電池電解質為能傳導 Li+的固體材料。
上面左圖中的小黑點表示_____(填粒子符號),充電時該電極反應式為_______。
(4)利用海洋資源可獲得MnO2 。MnO2可用來制備高錳酸鉀:將MnO2與KOH混合后在空氣中加熱熔融,得到綠色的錳酸鉀(K2MnO4),再利用氯氣將錳酸鉀氧化成高錳酸鉀。該制備過程中消耗相同條件下氯氣和空氣的體積比為_________(空氣中氧氣的體積分數按20%計)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素A,B,C,D的原子序數依次遞增,它們的核電荷數之和32,原子最外層電子數之和為10,A與C同主族,B與D同主族,A,C原子最外層電子數之和等于B原子的次外層電子數。則下列敘述中正確的是
A.D元素處于元素周期表中第3周期第Ⅳ族
B.四種元素的原子半徑:![]()
C.B,D的最高價氧化物中,B、D與氧原子均為雙鍵
D.一定條件下,B單質能置換出D單質,C單質能置換出A單質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I、如圖所示,X是一種生活中常見的金屬元素,A、B、C、D為石墨電極,E、F分別為短周期相鄰兩種活潑金屬中的一種,且E能與NaOH溶液反應。按圖示接通線路,反應一段時間(實驗中所有溶液均足量)。

(1)甲池是___(填“原電池”或“電解池”,下同]裝置;乙池是___裝置。
(2)D極為___(填“陰極”或“陽極”)。
(3)燒杯中溶液會變藍的是_______(填“a”或“b”);C極上的電極反應式為____。
(4)F極上的電極反應式為:____。
(5)當電路中通過0.02mol電子時,B電極上沉積0.64g金屬X,則X為___(填元素符號),甲池中反應的化學方程式為___。
II、(1)從輝銅礦中浸取銅元素,可用FeCl3作浸取劑。
①反應Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1molCuCl2,反應中轉移電子的數目為____;浸取時,在有氧環境下可維持Fe3+較高濃度。有關反應的離子方程式是___。
②浸取過程中加入洗滌劑溶解硫時,銅元素的浸取率的變化見如圖1。其原因是___。

③353K時,向FeCl3浸取液中加入CuCl2,能加快銅元素的浸取速率,其反應原理可用化學方程式表示為:___,CuCl+FeCl3=CuCl2+FeCl2。
(2)輝銅礦可由黃銅礦(主要成分為CuFeS2)通過電化學反應轉變而成,有關轉化見如圖2。轉化時正極的電極反應式為___。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫時,CH3COOH的電離平衡常數為K,向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH變化曲線如圖所示(忽略溫度變化)。下列說法中正確的是( )

A. b點表示的溶液中c(Na+)>c(CH3COO﹣)
B. c點表示CH3COOH和NaOH恰好反應完全
C. d點表示的溶液中c(CH3COO﹣) c(H+)/c(CH3COOH)大于K
D. b、c、d三點表示的溶液中一定都存在:c(Na+)+c(H+)═c(CH3COO﹣)+c(OH﹣)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生產、生活中產生的廢水、廢氣是環境污染的重要源頭。在環境治理方面人們可利用I2O5和Na2SO3等化工產品實現對廢水和廢氣的治理。 利用I2O5也可消除CO的污染,其反應原理為I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s) ΔH。已知在不同溫度(T1、T2)下,向裝有足量I2O5固體的2 L恒容密閉容器中通入2 mol CO,測得CO2氣體的體積分數φ(CO2)隨時間t的變化曲線如圖所示。
5CO2(g)+I2(s) ΔH。已知在不同溫度(T1、T2)下,向裝有足量I2O5固體的2 L恒容密閉容器中通入2 mol CO,測得CO2氣體的體積分數φ(CO2)隨時間t的變化曲線如圖所示。
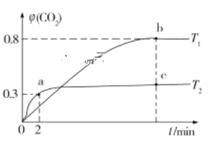
(1)溫度為T2時,0~2 min 內,CO2的平均反應速率υ(CO2)=__________________。
(2)b點時CO的轉化率為__________,化學反應的平衡常數K=_______(填表達式)。
(3)反應:I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)的ΔH______0(填“>”“<”或“=”)。
5CO2(g)+I2(s)的ΔH______0(填“>”“<”或“=”)。
(4)上述反應在T1下達到平衡時,再向容器中充入物質的量均為2 mol的CO和CO2氣體,則化學平衡________(填“向左”“向右”或“不”)移動。
(5)下列現象,可以表示上述反應達到平衡狀態的是____________(填字母)。
A.容器內的壓強不再變化
B.混合氣的平均相對分子質量不再變化
C.混合氣的密度不再變化
D.單位時間內消耗CO和生成CO2的物質的量之比為1∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉍為第五周期VA族元素,利用濕法冶金從輝鉍礦(含Bi2S3、Bi、Bi2O3等)提取金屬鉍的工藝流程如下圖所示:
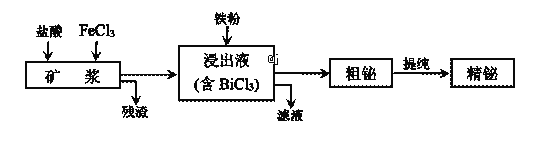
已知:BiCl3水解的離子方程式為:BiCl3+H2O![]() BiOCl+2H++2Cl-。
BiOCl+2H++2Cl-。
(1)礦漿浸出時加入鹽酸的作用是______________。
(2)浸出時,Bi溶于FeCl3溶液的化學方程式為________________。
(3)殘渣中含有一種單質,該單質是_______________。
(4)精輝鉍礦中含有Ag2S,被氧化溶解后不會進入浸出液,銀元素以___________(填化學式)進入殘渣中。
(5)粗鉍提純時,陰極的電極反應式:____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 時,在
時,在![]() 的密閉容器中充入
的密閉容器中充入![]() 和
和![]() ,一定條件下發生反應:
,一定條件下發生反應:![]() ,測得
,測得![]() 和
和![]() 的濃度隨時間變化如下表所示。下列說法不正確的是
的濃度隨時間變化如下表所示。下列說法不正確的是
時間 |
|
|
|
| 6 | 0 | ? |
| 3 | 1 |
|
A.![]() 時間內
時間內![]()
B.![]() 時,若升高溫度或再充入
時,若升高溫度或再充入![]() 氣體,都可以提高
氣體,都可以提高![]() 的轉化率
的轉化率
C.![]() 時,
時,![]() 正
正![]() 逆
逆![]()
D.![]() 時,平衡常數
時,平衡常數![]() ,
,![]() 與
與![]() 的轉化率相等
的轉化率相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】原電池原理的發現是儲能和供能技術的巨大進步,是化學對人類的一項重大貢獻。
(1)現有如下兩個反應:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑。上述反應中能設計成原電池的是______(填字母代號),負極Zn發生了_____反應(填“氧化”或“還原”)。
(2)將純鋅片和純銅片按如圖所示方式插入100 mL相同濃度的稀硫酸中一段時間,回答下列問題:

①下列說法正確的是_______(填字母代號)。
A.甲、乙均為化學能轉變為電能的裝置 B.乙中銅片上沒有明顯變化
C.甲中銅片質量減少、乙中鋅片質量減少 D.兩燒杯中溶液的pH均增大
②在相同時間內,兩燒杯中產生氣泡的速度:甲______乙(填“>”、“<“或“=”)。
③請寫出圖中構成原電池的裝置負極的電極反應式___________。
④當乙中產生1.12 L(標準狀況)氣體時,將鋅、銅片取出,再將燒杯中的溶液稀釋至1 L,測得溶液中c(H+)=0.1 mol·L-1(設反應前后溶液體積不變)。試確定原稀硫酸的物質的量濃度為_______
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com