
分析 (1)根據得失電子守恒,當x=n時碘離子恰好完全被氧化,生成碘單質,而x≤$\frac{n}{2}$時,碘離子只有極少部分被氧化;
(2)向FeI2溶液中通入氯氣,氯氣先和碘離子發(fā)生置換反應,然后再和亞鐵離子發(fā)生反應,根據氯氣和FeI2反應的離子方程式確定x與n的關系;
(2)n molFeI2的溶液中通入Cl2,有x molCl2發(fā)生反應,當x≤n時,氯氣只能氧化碘離子;
(3)氯氣先和碘離子發(fā)生置換反應,然后再和亞鐵離子發(fā)生反應,所以當Fe2+和I-兩種離子-同時被氧化時,x>n;
(4)當x=n時,只能氧化碘離子,根據2I-+Cl2=2Cl-+I2方程式計算可解.
解答 解:向FeI2溶液中通入氯氣,氯氣先和碘離子發(fā)生置換反應2I-+Cl2=2Cl-+I2,然后再和亞鐵離子發(fā)生反應2Fe2++Cl2=Fe3++2Cl-;所以在含有n molFeI2的溶液中通入Cl2,有x molCl2發(fā)生反應,
當$\frac{x}{n}$≥$\frac{3}{2}$時,碘離子、二價鐵離子全部被氧化;$\frac{x}{n}$≤1時,只能氧化碘離子;1<$\frac{x}{n}$<$\frac{3}{2}$時,既氧化全部碘離子,又氧化部分二價鐵離子.
(1)根據得失電子守恒,當x=n時碘離子恰好完全被氧化,生成碘單質,而x≤$\frac{n}{2}$時,碘離子只有極少部分被氧化,所以反應的離子方程式為:2I-+Cl2=I2+2Cl-,故答案為:2I-+Cl2=I2+2Cl-;
(2)當反應的離子方程式為:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-時,由方程式可知:當參加反應的FeI2為2mol時,通入的氯氣為3mol,此時碘離子、二價鐵離子全部被氧化,氯氣可以過量,所以,在含有n molFeI2的溶液中通入x molCl2,x與n的關系為$\frac{x}{n}$≥$\frac{3}{2}$,即x≥1.5n,
故答案為:x≥1.5n;
(3)當Fe2+和I-兩種離子-同時被氧化時,反應中先氧化全部碘離子,然后剩余的氯氣再氧化二價鐵離子,x>n,
故答案為:x>n;
(4)x=1.25n時,2nmol的I-全部被氧化,0.25×2mol的Fe2+被氧化,所以氧化產物為nmolI2和0.5mol的Fe3+,所以氧化產物一共1.5nmol,故答案為:1.5nmol.
點評 本題以氯氣和碘化亞鐵的反應為載體考查了氧化還原反應,明確溶液中離子反應的先后順序是解本題的關鍵,采用極值討論法來分析解答較簡便,題目難度中等.


 學而優(yōu)銜接教材南京大學出版社系列答案
學而優(yōu)銜接教材南京大學出版社系列答案 小學課堂作業(yè)系列答案
小學課堂作業(yè)系列答案 金博士一點全通系列答案
金博士一點全通系列答案科目:高中化學 來源: 題型:選擇題
 甲溶液中含Aa+離子濃度為0.10mol/L,乙溶液含Bb-離子濃度為0.35mol/L,取不同體積甲、乙兩溶液的物質的量如圖所示.則沉淀物的化學式為( )
甲溶液中含Aa+離子濃度為0.10mol/L,乙溶液含Bb-離子濃度為0.35mol/L,取不同體積甲、乙兩溶液的物質的量如圖所示.則沉淀物的化學式為( )| A. | A2B3 | B. | A3B2 | C. | AB2 | D. | A2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 清潔能源具有廣闊的開發(fā)和應用前景,可減少污染解決霧霾問題,其中甲醇、甲烷是優(yōu)質的清潔燃料,可制作燃料電池.
清潔能源具有廣闊的開發(fā)和應用前景,可減少污染解決霧霾問題,其中甲醇、甲烷是優(yōu)質的清潔燃料,可制作燃料電池.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可加入燒堿溶液以提高電池的性能,堿性電池的能量和可儲存時間均較高 | |
| B. | 放電時電池內部Li+向負極移動 | |
| C. | 充電過程中,電池正極材料的質量減少 | |
| D. | 放電時電池正極反應為:FePO4+Li+-e-═LiFePO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol•L-1的CH3COOH溶液的pH=2 | B. | CH3COOH溶液中含有CH3COOH分子 | ||
| C. | CH3COOH能與NaOH發(fā)生中和反應 | D. | 常溫下CH3COONa溶液的pH=8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 100℃下水的電離程度較大 | B. | 前者的C(H+)較后者小 | ||
| C. | 水的電離過程是一個放熱過程 | D. | 溫度越高,Kw越大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
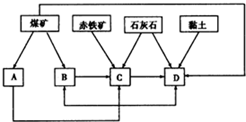 我國某地區(qū)已探明蘊藏有豐富的赤鐵礦(主要成分為Fe2O3,還含有SiO2等雜質)、煤礦、石灰石和黏土.擬在該地區(qū)建設大型煉鐵廠.
我國某地區(qū)已探明蘊藏有豐富的赤鐵礦(主要成分為Fe2O3,還含有SiO2等雜質)、煤礦、石灰石和黏土.擬在該地區(qū)建設大型煉鐵廠.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 容量瓶內有水,未經過干燥處理 | |
| B. | 定容時,仰視刻度線 | |
| C. | 用量筒量取濃NaOH溶液時,用水洗滌量筒2~3次,洗滌液倒入燒杯中 | |
| D. | 定容后倒轉容量瓶幾次,發(fā)現液體最低點低于刻度線,再補加幾滴水到刻度線 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com