
25℃時,三種酸的電離平衡常數如下表所示。
化學式 | CH3COOH | HClO | H3PO3 |
名稱 | 醋酸 | 次氯酸 | 亞磷酸 |
電離平衡常數(25℃) | 1.8×10-5 | 3.0×10-8 | K1=8.3×10-3 K2=5.6×10-6 |
回答下列問題:
(1)亞磷酸(H3PO3)為二元中強酸,具有較強的還原性,可將銀離子還原成銀單質,在空氣可緩慢氧化成H3PO4。H3PO3的電離方程式為 。
(2)物質的量濃度均為0.1 mol·L-1的三種溶液:a.CH3COONa b.NaClO c.NaHPO3它們的pH由小到大排列順序是 (用字母表示)。
(3)常溫下,0.1 mol·L-1的CH3COOH溶液加水稀釋過程中,下列表達式的數據一定變小的是________(填字母)。
A.c(H+) B.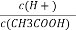
C.c(H+)·c(OH-) D.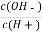
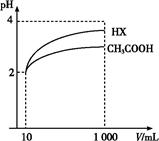
(4)體積為10 mL、 pH均為2的醋酸溶液與一元酸HX分別加水稀釋至1 000 mL,稀釋過程中pH變化如圖所示,則HX的電離平衡常數________(填“大于”、“等于”或“小于”)醋酸的平衡常數
 沖刺100分1號卷系列答案
沖刺100分1號卷系列答案科目:高中化學 來源:2017屆吉林長春外國語學校高三上期末化學試卷(解析版) 題型:實驗題
硼位于ⅢA族,三氯化硼 (BCl3)可用于制取乙硼烷(B2H6),也可作有機合成的催化劑,三氯化硼遇水劇烈反應。
查閱資料:①BCl3的沸點為12.5 ℃,熔點為-107.3 ℃;
②2B+6HCl 2BCl3↑+3H2↑;
2BCl3↑+3H2↑;
③硼與鋁的性質相似,也能與氫氧化鈉溶液反應
設計實驗:某同學設計如圖所示裝置,利用氯氣和單質硼反應制備三氯化硼
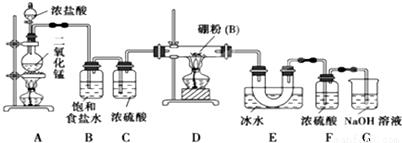
回答下列問題:
(1)寫出A裝置中反應的化學方程式 ,
(2)B的作用 ,C的作用 ,實驗結束后在E中收集到的物質是 (填化學式)
(3)G的作用是吸收含Cl2尾氣,寫出G中反應的化學方程式 ,
(4)實驗中可以用一個盛裝 (填試劑名稱)的干燥管代替F和G裝置,使實驗更簡便。
(5)為了順利完成實驗,正確的操作是 (填序號)
①先點燃D處酒精燈,后點燃A處酒精燈
②先點燃A處酒精燈,后點燃D處酒精燈
③同時點燃A、D處酒精燈
(6)請你補充完整下面的簡易實驗,以驗證制得的產品中是否含有硼粉:取少量樣品于試管中,滴加濃 (填化學式)溶液,若有氣泡產生,則樣品中含有硼粉;若無氣泡產生,則樣品中無硼粉。
查看答案和解析>>
科目:高中化學 來源:2017屆北京市豐臺區高三上學期期末化學試卷(解析版) 題型:選擇題
下列反應的發生與沉淀溶解平衡或鹽類水解平衡的移動無關的是
A.硝酸銀溶液與鹽酸反應生成氯化銀
B.鎂條與氯化銨溶液反應生成氫氣
C.鹽酸與碳酸鈣反生成二氧化碳
D.硫酸鋁溶液和小蘇打溶液反應生成二氧化碳
查看答案和解析>>
科目:高中化學 來源:2017屆北京市昌平區高三上學期期末化學試卷(解析版) 題型:選擇題
已知可用Co2O3代替MnO2制備Cl2,反應后Co元素以 Co2+的形式存在。下列敘述不正確的是
A.該反應中氧化性:Co2O3>Cl2
B.參加反應的HCl全部被Co2O3氧化
C.每生成1摩爾氯氣,消耗1摩爾Co2O3
D.制備相同量的氯氣,所需Co2O3質量比MnO2多
查看答案和解析>>
科目:高中化學 來源:2017屆北京市昌平區高三上學期期末化學試卷(解析版) 題型:選擇題
下列化學用語正確的是
A.硫離子的結構示意圖:
B.FeSO3的名稱是亞硫酸鐵
C.電子轉移情況: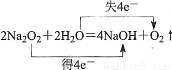
D.氮氣分子的電子式: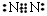
查看答案和解析>>
科目:高中化學 來源:2016-2017學年吉林省長春市五縣高二上期末化學試卷(解析版) 題型:選擇題
一定條件下,在密閉容器中充入一定量的X和Y發生可逆反應:X(g)+2Y(g)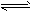 3Z(g),達到平衡,測得Y的轉化率為 37.5%,X的轉化率為25%,則反應開始時,充入容器中的X和Y的物質的量之比為( )
3Z(g),達到平衡,測得Y的轉化率為 37.5%,X的轉化率為25%,則反應開始時,充入容器中的X和Y的物質的量之比為( )
A.1∶3 B.3∶1 C.4∶3 D.3∶4
查看答案和解析>>
科目:高中化學 來源:2016-2017學年吉林省長春市五縣高二上期末化學試卷(解析版) 題型:選擇題
在隔絕空氣的條件下發生反應:CH4(g)=C(g)+2H2(g) △H>0,下列說法正確的是( )
A.低溫下是非自發反應,高溫下是自發反應
B.任何溫度下都是自發反應
C.低溫下是自發反應,高溫下是非自發反應
D.任何溫度下都是非自發反應
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江、吉林省兩省六校高一上期中化學試卷(解析版) 題型:選擇題
下列離子方程式正確的是( )
A.氧化鐵和稀硫酸反應:Fe2O3+6H+ =2Fe2++3H2O
B.碳酸氫鈉溶液中加稀硫酸:CO32-+ 2H+=H2O+CO2↑
2H+=H2O+CO2↑
C.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好為中性:
Ba2+ + OH- + H+ + SO42-=BaSO4↓+ H2O
D.Cu(OH)2加入H2SO4:2H++Cu(OH)2 = Cu2+ +2H2O
查看答案和解析>>
科目:高中化學 來源:2017屆廣東省惠州市高三上第三次調研化學試卷(解析版) 題型:填空題
[物質結構與性質]氧元素和鹵族元素都能形成多種物質,我們可以利用所學物質結構與性質的相關知識去認識和理解。
(1)溴的價電子排布式為 ;PCl3的空間構型為 。
(2)已知CsICl2不穩定,受熱易分解,傾向于生成晶格能更大的物質,則它按下列 式發生:
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(3)根據下表第一電離能數據判斷:最有可能生成較穩定的單核陽離子的鹵素原子是__________
氟 | 氯 | 溴 | 碘 | |
第一電離能(kJ•mol﹣1) | 1681 | 1251 | 1140 | 1008 |
(4)下列分子既不存在s﹣pσ鍵,也不存在p﹣pπ鍵的是
A. HCl B.HF C. SO2 D. SCl2
(5)已知COCl2為平面形,則COCl2中心碳原子的雜化軌道類型為 ,寫出CO的等電子體的微粒 (寫出1個)。
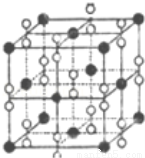
(6)鈣在氧氣中燃燒時得到一種鈣的氧化物晶體,其結構如圖所示:由此可判斷該鈣的氧化物的化學 式為 。已知該氧化物的密度是ρg•cm﹣3,則晶胞離得最近的兩個鈣離子間的距離為 cm(只要求列算式,不必計算出數值,阿伏加德羅常數為NA)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com