
金屬材料在人類生產生活中有著重要的應用,但人們使用更多的不是純金屬,而是合金。
(1)快中子反應堆的熱交換劑用的是鈉鉀合金,其常溫下是 態(填氣、液、固)。把鈉的物質的量分數為20%的0.2mol的此合金安全地加入到重水(D2O)中,產生的氣體物質所含的中子數為 。
(2)鎂鋁合金是經常見到的輕質合金。剪一塊合金在空氣中燃燒,除生成MgO和Al2O3外,最有可能生成的第三種物質的電子式是 。當一塊5.1g的鎂鋁合金薄片溶于3.6 mol·L-1的200ml 的硫酸溶液中,至少需加入1 mol·L-1的氫氧化鈉溶液的體積 mL至沉淀質量不再改變,如整個過程中有0.5mol 的電子發生轉移,則合金中Mg的物質的量分數為 。
(3)①有一種銅的合金即黃銅(可看作是Cu和Zn),可分別用酸溶法或堿溶法來分離該兩種金屬,其中把該合金投入到稀鹽酸中,發現產生氣泡的速度比用鋅與鹽酸反應制氫氣的速度快,其原因是 。
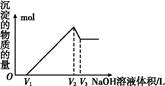
②為分析某銅合金的成分,用酸將其完全溶解后,用NaOH溶液調pH,當pH=3.4時開始出現沉淀,分別在pH為7.0、8.0時過濾沉淀。結合下圖信息推斷該合金中除銅外一定含有 。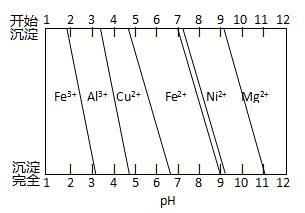
(1)液 0.2NA (2)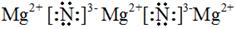 1440;50%
1440;50%
(3)①銅鋅合金可以形成原電池,加快化學反應速率。 ②Al、Ni
解析試題分析:(1)鈉鉀合金,其常溫下是液態;鈉的物質的量分數為20%的0.2mol的此合金中鈉和鉀的物質的量分別是0.04mol和0.16mol。根據方程式2Na+2H2O=2NaOH+H2↑↑可知,與水反應生成氫氣的物質的量分別是0.02mol和0.08mol,共計是0.10mol。由于氫氣的組成D2,分子中含有中子數是2個,所以產生的氣體物質所含的中子數為0.2NA。
(2)由于鎂能與氮氣反應生成氮化鎂,而空氣中含有大量的氮氣,所以第三種物質應該是氮化鎂,氮化鎂是離子化合物,電子式為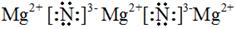 。當沉淀不再發生變化時,此時恰好反應生成氫氧化鎂和氫氧化鋁沉淀,而溶液中只含有硫酸鈉,物質的量是3.6mol/L×0.2L=0.72mol,則關節炎鈉離子守恒可知,至少需要氫氧化鈉的物質的量是0.72mol×2=1.44mol,其溶液體積為1.44mol÷1.0mol/L=1.44L=1440ml;設合金中Mg、Al的物質的量分別為x和y,則2x+3y=0.5mol、24g/mol×x+27g/mol×y=5.1g,解得x=y=0.1mol,因此合金中Mg的物質的量分數為50%。
。當沉淀不再發生變化時,此時恰好反應生成氫氧化鎂和氫氧化鋁沉淀,而溶液中只含有硫酸鈉,物質的量是3.6mol/L×0.2L=0.72mol,則關節炎鈉離子守恒可知,至少需要氫氧化鈉的物質的量是0.72mol×2=1.44mol,其溶液體積為1.44mol÷1.0mol/L=1.44L=1440ml;設合金中Mg、Al的物質的量分別為x和y,則2x+3y=0.5mol、24g/mol×x+27g/mol×y=5.1g,解得x=y=0.1mol,因此合金中Mg的物質的量分數為50%。
(3)①由于鋅的金屬性強于銅,通入到鹽酸中,銅鋅合金可以形成原電池,加快化學反應速率。
②由圖可知,結合題中信息可知開始出現沉淀為Al(OH)3、pH=8.0時過濾除去Ni(OH)2,因此該銅合金中還含Al、Ni。
考點:考查金屬、合金的組成與性質、根據方程式進行的有關計算以及溶解平衡的應用


科目:高中化學 來源: 題型:填空題
從明礬[KAl(SO4)2·12H2O]制備Al、K2SO4和H2SO4的流程如下: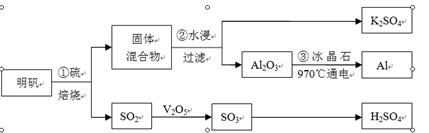
明礬焙燒的化學方程式為:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2↑+48H2O
請回答下列問題:
(1)在焙燒明礬的反應中,氧化劑是 。
(2)步驟②中,為提高浸出率,可采取的措施有 。
| A.粉碎固體混合物 | B.降低溫度 | C.不斷攪拌 | D.縮短浸泡時間 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
以硫鐵礦燒渣(含有氧化鐵和少量硫化亞鐵、二氧化硅等)為原料制備聚鐵{可表示為Fe2(OH)n(SO4)3-n/2,和綠礬(FeSO4.7H2O)具有成本低、反應快、產品質量高等優點。制備流程如下圖: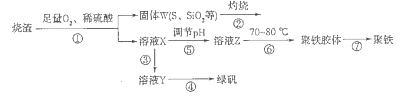
(1)流程圖中溶液X為Fe(SO4)3,溶液,據此寫出操作①中屬于氧化還原反應的離子方程式:____________。
(2)操作②的處理存在弊端,該弊端是_____________。若固體W與KOH溶液昆合加熱,其中一個反應的化學方程式為3S+6KOH 2K2S+K2SO3+3H2O,該反應的氧化劑與還原劑質量之比為___________。
2K2S+K2SO3+3H2O,該反應的氧化劑與還原劑質量之比為___________。
(3)操作③需要加入的物質(試劑)是_________,目的是___________________________。
(4)操作⑤是使溶液pH___________(填“增大”或“減小”)。
(5)操作⑥控制溫度為70 -80℃的目的是_________________________________________ 。
(6)雙氧水在酸性環境(硫酸)中是一種強氧化劑,可以將硫酸亞鐵氧化成三價鐵,制得Fe2(OH)n(SO4)3-n/2,反應的化學方程式為__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
檸檬酸亞鐵(FeC6H6O7)是一種易吸收的高效鐵制劑,可由綠礬(FeSO4·7H2O)通過下列反應制備:
FeSO4+Na2CO3=FeCO3+Na2SO4
FeCO3+C6H8O7=FeC6H6O7+CO2+H2O
下表列出了相關金屬離子生成氫氧化物沉淀的pH(開始沉淀的pH按金屬離子濃度為1.0 mol·L-1計算)。
| 金屬離子 | 開始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
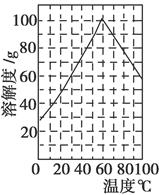
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
Fe元素是地殼中最豐富的元素之一,在金屬中含量僅次于鋁,鐵及其化合物在生活生產中有廣泛應用。請回答下列問題。
(1)磁鐵礦是工業上冶煉鐵的原料之一,其原理是Fe3O4+4CO 3Fe+4CO2,若有1 mol Fe3O4參加反應,轉移電子的物質的量是________ mol。
3Fe+4CO2,若有1 mol Fe3O4參加反應,轉移電子的物質的量是________ mol。
(2)與明礬相似,硫酸鐵也可用作凈水劑,在使用時發現硫酸鐵并不能使酸性廢水中的懸浮物沉降除去,其原因是___________________________________________________。
(3)某課外活動小組將下圖所示裝置按一定順序連接,在實驗室里制取一定量的FeCl3(所通氣體過量并充分反應)。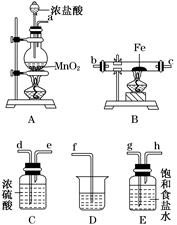
請回答下列問題:
①各裝置的正確連接順序為(填寫裝置代號)
A→________→________→________→D。
②裝置C的作用是_______________________________________________________。
③反應開始后,B中硬質玻璃管內的現象為________;可以檢驗生成物中含有Fe3+的試劑是________(填寫試劑名稱)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氯化鐵是常見的水處理劑,無水FeCl3易升華。工業上制備無水FeCl3的一種工藝如圖所示:
(1)加入吸收塔的吸收劑X應是 (填字母編號)。
a.NaOH溶液 b.飽和食鹽水 c.FeCl2溶液 d.淀粉KI溶液
(2)取0.5 mL飽和FeCl3溶液滴入50 mL沸水中,得紅褐色氫氧化鐵膠體,則發生反應的離子方程式為 。
(3)實驗室中從FeCl3溶液制得FeCl3·6H2O晶體的過程中,需先加入 且保持過量,然后進行的操作依次為 、冷卻結晶、過濾。
(4)將H2S氣體通入FeCl3溶液中會出現渾濁,則其反應的離子方程式為 。
(5)鐵鉻氧化還原液流電池是一種低成本的儲能電池,電池結構如圖所示(電極材料為石墨),工作原理為:Fe3++Cr2+ Fe2++Cr3+
Fe2++Cr3+
則電池放電時,Cl-將移向 極(填“正”或“負”);充電時,陰極的電極反應式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某研究小組將一批廢棄的線路板經濃硝酸和稀硫酸處理后得到一混合溶液,其中含有Cu2+、Fe2+、Fe3+、Al3+等金屬離子,并設計了以下兩種流程以分別制取CuSO4·5H2O晶體和AlCl3
溶液: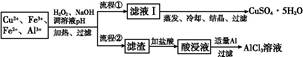
已知:相關金屬離子開始沉淀至完全沉淀時的pH范圍為:
| 離子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范圍 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
以黃銅礦(主要成分是CuFeS2,含少量雜質SiO2)為原料煉銅的方法分為高溫煉銅和濕法煉銅兩種。近年來,濕法煉銅有了新進展,科學家發現有一種細菌在酸性水溶液、氧氣存在下,可以將黃銅礦氧化成硫酸鹽:4CuFeS2+2H2SO4+17O2 4CuSO4+2Fe2(SO4)3+2H2O。某工廠運用該原理生產銅和綠礬的工藝如下:
4CuSO4+2Fe2(SO4)3+2H2O。某工廠運用該原理生產銅和綠礬的工藝如下: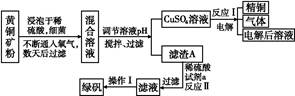
回答下列問題:
(1)下列物質中可以用于上述流程中調節溶液pH的是 (填序號)。
| A.Cu; | B.Cu2(OH)2CO3; | C.H2SO4; | D.Fe;E.CuO |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某工廠的電鍍污泥中含有銅、鐵等金屬化合物。為實現資源的回收利用并有效防止環境污染,設計如下工藝流程:
(1)酸浸后加入H2O2的目的是 。調pH步驟中加入的試劑最好是 (填化學式)。實驗室進行過濾操作所用到的玻璃儀器有 。
(2)煮沸CuSO4溶液的原因是 。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,寫出該反應的化學方程式 。
(3)稱取所制備的CuCl樣品0.2500g置于一定量的0.5mol·L-1FeCl3溶液中,待樣品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定,到達終點時消耗Ce(SO4)2溶液25.00mL。有關的化學反應為:Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。計算該CuCl樣品的質量分數 。
(4)Fe3+發生水解反應Fe3++3H2O Fe(OH)3+3H+,該反應的平衡常數表達式為 。
Fe(OH)3+3H+,該反應的平衡常數表達式為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com