
【題目】請根據表格中提供的甲、乙、丙、丁四種元素的相關信息完成下列問題:
元素 | 甲 | 乙 | 丙 | 丁 |
原子序數 | 11 | ③ | ||
元素符號 | ② | S | ||
原子結構示意圖 | ① |
| ||
元素周期表中的位置 | 第三周期第ⅢA族 | ④ |
(1)填寫表格中各序號所對應的空白:①_________________②__________________
③_________________④_________________。
(2)甲、乙、丙、丁四種元素中,原子半徑最大的是____________(填元素符號),丁元素的最高正價為______________價。
(3)元素的最高價氧化物對應水化物中堿性最強的是_________(填化學式,下同), 呈兩性的氫氧化物是__________________,酸性最強的是__________________。
(4)最高價氧化物對應水化物的堿性:甲_______________乙(填“>”或“<”),簡單氣態氫化物的穩定性:丙_______________丁(填“>”或“<”)。
(5)元素乙的最高價氧化物對應水化物,既能與元素甲的最高價氧化物對應水化物反應,又能中和過多的胃酸。請寫出中和胃酸的離子方程式:_________________________。
【答案】 Al 16 第三周期第ⅦA族 Na +7 NaOH Al(OH)3 HClO4 > < Al(OH)3+3H+=Al3++3H2O
Al 16 第三周期第ⅦA族 Na +7 NaOH Al(OH)3 HClO4 > < Al(OH)3+3H+=Al3++3H2O
【解析】
11號元素甲是鈉元素,核外有11個電子;元素乙位于第三周期第ⅢA族,乙是Al元素;丙是S元素,原子序數是16;元素丁的原子結構示意圖是![]() ,質子數的17,丁為Cl元素。
,質子數的17,丁為Cl元素。
(1)①甲是鈉元素,核外有11個電子,原子結構示意圖是 ;②乙位于第三周期第ⅢA族,原子序數是13,元素符號是Al;③丙是S元素,原子序數是16;④丁是Cl元素,在周期表的第三周期第ⅦA族。
;②乙位于第三周期第ⅢA族,原子序數是13,元素符號是Al;③丙是S元素,原子序數是16;④丁是Cl元素,在周期表的第三周期第ⅦA族。
(2)同周期元素從左到右半徑逐漸減小,Na、Al、S、Cl四種元素中,原子半徑最大的是Na,元素的最高正價等于最外層電子數,氯原子最外層有7個電子,最高正價為+7價。
(3)同周期元素從左到右金屬性減弱,元素金屬性越強最高價氧化物對應水化物的堿性越強,最高價氧化物對應水化物中堿性最強的是NaOH,呈兩性的氫氧化物是Al(OH)3;同周期元素從左到右非金屬性增強,元素非金屬性越強最高價氧化物對應水化物的酸性越強,酸性最強的是HClO4。
(4)鈉的金屬性大于鋁,最高價氧化物對應水化物的堿性:甲>乙,元素非金屬性越強,簡單氣態氫化物的穩定性越強,非金屬性S<Cl,所以穩定性:丙<丁。
(5)元素Al的最高價氧化物對應水化物是Al(OH)3 ,胃酸的成分是鹽酸,反應的離子方程式是Al(OH)3+3H+=Al3++3H2O。


科目:高中化學 來源: 題型:
【題目】目前世界上60%的鎂是從海水中提取的。海水提鎂的主要流程如下:
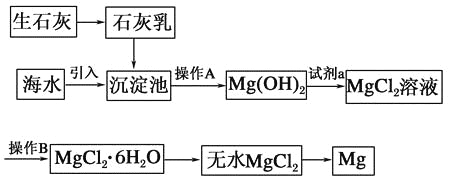
請回答下列問題:
(1)從離子反應的角度思考,在海水中加入石灰乳的作用是________,寫出在沉淀池中發生反應的離子方程式:_________________________________________________。
(2)石灰乳是生石灰與水形成的化合物,從充分利用海洋化學資源,提高經濟效益的角度考慮,生產生石灰的主要原料來源于海洋中的________。
(3)操作A是________,操作B是________。
(4)加入的足量試劑a是________(填化學式)。
(5)無水MgCl2在熔融狀態下,通電后會產生Mg和Cl2,該反應的化學方程式為________,從考慮成本和廢物循環利用的角度,副產物氯氣可以用于________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25 ℃時濃度都是1 mol/L的四種正鹽溶液:AX、BX、AY、BY。AX溶液的pH=7且溶液中c(X-)=1 mol/L,BX溶液的pH=4,BY溶液的pH=6。下列說法正確的是( )
A. 電離平衡常數:K(BOH)<K(HY)
B. AY溶液的pH小于BY溶液的pH
C. 稀釋相同倍數,溶液pH變化:BX等于BY
D. 將pH均為1的HX和HY溶液分別稀釋10倍后,HX溶液的pH小于HY溶液的pH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應過程中的能量變化與右圖一致的是
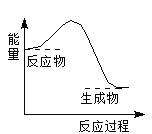
A. 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
B. C+CO2![]() 2CO
2CO
C. CaCO3![]() CaO+CO2↑
CaO+CO2↑
D. C+H2O![]() CO+H2
CO+H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在固定容積的密閉容器中發生的可逆反應:X(g)+3Y(g) ![]() 2Z(g),下列說法能充分說明該反應已經達到平衡狀態的是( )
2Z(g),下列說法能充分說明該反應已經達到平衡狀態的是( )
A. X、Y、Z的濃度均不再發生變化B. X、Y、Z在容器中共存
C. v(正) = v(逆) = 0D. 單位時間內消耗a mol X同時生成2a mol Z
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(題文)常溫下,某水溶液M中存在的離子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根據題意回答下列問題:
(1)寫出酸H2A的電離方程式_________________________。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液與10 mL 2 mol·L-1 NaOH溶液等體積混合而成,則溶液M的pH________(填“<”“>”或“=”)7,溶液中離子濃度由大到小的順序為______________。已知Ksp(BaA)=1.8×10-10,向該溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+濃度為________mol·L-1。
(3)若有下列三種溶液:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl與0.04 mol·L-1的NaHA溶液等體積混合,則三種情況下,溶液中c(H2A)最大的是____________;pH由大到小的順序為______________。
(4)若溶液M由pH=3的H2A溶液V1 mL與pH=11的NaOH溶液V2 mL混合反應而得,混合溶液中![]() =104,V1與V2的大小關系為________(填“V1大于V2”“V1等于V2”“V1小于V2”或“均有可能”)。
=104,V1與V2的大小關系為________(填“V1大于V2”“V1等于V2”“V1小于V2”或“均有可能”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列根據反應原理設計的應用,不正確的是
A. CO32-+H2O![]() HCO3-+OH- 熱的純堿溶液清洗油污
HCO3-+OH- 熱的純堿溶液清洗油污
B. Al3++3H2O![]() Al(OH)3+3H+ 明礬凈水
Al(OH)3+3H+ 明礬凈水
C. TiCl4+(x+2)H2O(過量) ![]() TiO2·xH2O↓+4HCl 用TiCl4制備TiO2
TiO2·xH2O↓+4HCl 用TiCl4制備TiO2
D. SnCl2+H2O![]() Sn(OH)Cl↓+HCl 配制氯化亞錫溶液時加入氫氧化鈉
Sn(OH)Cl↓+HCl 配制氯化亞錫溶液時加入氫氧化鈉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對可逆反應4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列敘述中正確的是
4NO(g)+6H2O(g),下列敘述中正確的是
A. 達到化學平衡時4v正(O2)=5v逆(NO)
B. 若單位時間內生成x mol NO的同時,消耗x mol NH3,則反應達到平衡狀態
C. 達到化學平衡時,若增大容器的體積,則正反應速率減小,逆反應速率增大
D. 化學反應速率的關系是2v逆(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以葡萄糖為原料制得的山梨醇(A)和異山梨醇(B)都是重要的生物質轉化平臺化合物。E是一種治療心絞痛的藥物,由葡萄糖為原料合成E的過程如下:
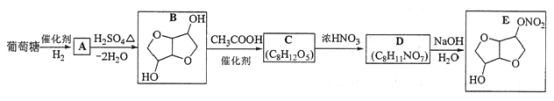
回答下列問題:
(1)葡萄糖的分子式為__________。
(2)A中含有的官能團的名稱為__________。
(3)由B到C的反應類型為__________。
(4)C的結構簡式為__________。
(5)由D到E的反應方程式為______________。
(6)F是B的同分異構體,7.30 g的F與足量飽和碳酸氫鈉反應可釋放出2.24 L二氧化碳(標準狀況),F的可能結構共有________種(不考慮立體異構),其中核磁共振氫譜為三組峰,峰面積比為3∶1∶1的結構簡式為_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com