
| A.加入NH4HSO4固體,v(H2)不變 |
| B.加入Na2SO4固體,v(H2)減小 |
| C.加入CH3COONa固體,v(H2)減小 |
| D.滴加少量CuSO4溶液,v(H2)減小 |
 能力評價系列答案
能力評價系列答案 唐印文化課時測評系列答案
唐印文化課時測評系列答案科目:高中化學 來源:不詳 題型:填空題
| 實驗編號 | 反應物 | 催化劑 |
| ① | 10mL2%H2O2溶液 | 無 |
| ② | 10mL5%H2O2溶液 | 無 |
| ③ | 10mL5%H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5%H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |
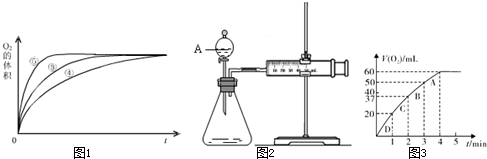
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.粗鋅與稀硫酸反應制氫氣比純鋅快,是因為粗鋅比純鋅還原性強 |
| B.催化劑不影響反應活化能,從而只影響反應速率,不影響化學平衡 |
| C.向包有Na2O2的脫脂棉吹氣后脫脂棉燃燒,說明CO2、H2O與Na2O2反應是放熱反應 |
| D.強電解質水溶液的導電性一定大于弱電解質水溶液的導電性 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題
| 負極材料 | 正極材料 | 負極反應式 | 正極反應式 | 電解質溶液 | |
| 實驗三 | Zn | 雜質 | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 鹽酸 |
| 實驗四 | Zn | Cu | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 鹽酸 |
| 負極材料 | 正極材料 | 負極反應式 | 正極反應式 | 電解質溶液 | |
| 實驗三 | Zn | 雜質 | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 鹽酸 |
| 實驗四 | Zn | Cu | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 鹽酸 |

查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.甲>乙 | B.甲<乙 | C.甲=乙 | D.無法確定 |
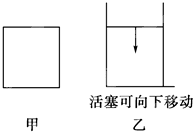
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.增大煤炭燃燒時的燃燒熱并形成清潔能源 |
| B.減少爐中雜質氣體(如SO2等)的形成 |
| C.提高煤炭的熱效率并減少CO的排放 |
| D.使得燃料燃燒充分,從而提高燃料的利用率 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.使用催化劑有利于加快合成氨反應的反應速率 |
| B.硫酸工業中,將黃鐵礦粉碎后加入沸騰爐中 |
| C.500℃左右比在室溫時更有利于提高合成氨的轉化率 |
| D.配制氯化鐵溶液時,將氯化鐵加入鹽酸中,然后加水稀釋 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 CO(g)+3H2(g);△H>0
CO(g)+3H2(g);△H>0| 溫度/℃ | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
 H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下:
H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com