
在體積為1L的兩個(gè)恒容密閉容器中,分別充入1molCO和1molH2O(g)的混合氣體,進(jìn)行如下化學(xué)反應(yīng):CO(g)+H2O(g) CO2(g)+H2(g),反應(yīng)物CO的物質(zhì)的量在不同溫度時(shí)物質(zhì)的量隨時(shí)間的變化如下表所示,回答下列問(wèn)題:
CO2(g)+H2(g),反應(yīng)物CO的物質(zhì)的量在不同溫度時(shí)物質(zhì)的量隨時(shí)間的變化如下表所示,回答下列問(wèn)題:
|
|
0min |
10min |
20min |
30min |
40min |
50min |
|
830℃ |
1mol |
0.8mol |
0.65mol |
0.55mol |
0.5mol |
0.5mol |
|
1100℃ |
1mol |
0.75mol |
0.6mol |
0.6mol |
0.6mol |
0.6mol |
(1)1100℃時(shí),前10min該反應(yīng)的化學(xué)反應(yīng)速率v(CO2)= ,830℃平衡后CO轉(zhuǎn)化率的為_(kāi)_________________。
(2)1100℃時(shí)化學(xué)平衡常數(shù)K=_______,該反應(yīng)為_(kāi)_______反應(yīng)(填“吸熱”和“放熱”)。
(3)能判斷該反應(yīng)是否達(dá)到化學(xué)平衡狀態(tài)的依據(jù)是____________________。
(a)容器中壓強(qiáng)不變 (b)混合氣體中c(CO)不變
(c)v逆(H2)=v正(H2O) (d)c(CO2)=c(CO)
(4)1100℃時(shí)達(dá)到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡_____________________移動(dòng)(選填“向正反應(yīng)方向”或“向逆反應(yīng)方向”或“不”),再達(dá)到平衡時(shí),H2百分含量________________(選填“增大”或“減小”或“不變”)。
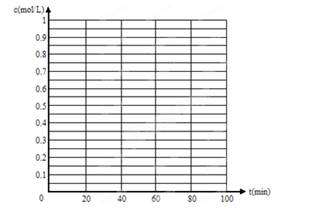
(5)830℃時(shí),若在體積為2L的密閉容器中充入1molCO2和1molH2的混合氣體,60min時(shí)反應(yīng)達(dá)平衡狀態(tài),畫(huà)出c(CO)和c(H2)隨時(shí)間變化而變化的趨勢(shì)圖。
(1)0.025mol/(L·min) (1分) 50%(1分)
(2)4/9(或0.44)(2分) 放熱(1分) (3)bc(2分)
(4)正反應(yīng)方向 (1分) 不變(1分) (5)見(jiàn)圖(兩條曲線各2分,沒(méi)標(biāo)物質(zhì)各扣0.5分)
【解析】(1)1100℃時(shí),前10min內(nèi)CO的物質(zhì)的量減少了0.25mol,所以生成CO2時(shí)0.25mol,則CO2的反應(yīng)速率是0.25mol÷1L÷10min=0.025mol/(L·min) 。830℃平衡后剩余CO是0.5mol,所以,消耗CO是0.5mol,因此轉(zhuǎn)化率是0.5÷1×100%=50%。
(2)1100℃平衡時(shí)CO(g)、H2O(g)、CO2(g)、H2(g)物質(zhì)的量分別是0.6mol、0.6mol、0.4mol、0.4mol,所以平衡常數(shù)=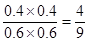 。溫度越高平衡時(shí)CO的物質(zhì)的量越大,說(shuō)明升高溫度平衡向逆反應(yīng)方向移動(dòng),所以正反應(yīng)是放熱反應(yīng)。
。溫度越高平衡時(shí)CO的物質(zhì)的量越大,說(shuō)明升高溫度平衡向逆反應(yīng)方向移動(dòng),所以正反應(yīng)是放熱反應(yīng)。
(3)在一定條件下,當(dāng)可逆反應(yīng)中正反應(yīng)速率和逆反應(yīng)速率相等時(shí)(但不為0),各種物質(zhì)的濃度或含量均不再發(fā)生變化的狀態(tài),是化學(xué)平衡狀態(tài)。所以b正確。平衡時(shí)濃度不再發(fā)生變化,但物質(zhì)之間的濃度不一定相等或滿足某種關(guān)系,d不正確。反應(yīng)前后體積不變,所以壓強(qiáng)始終是不變的,a不正確。C中反應(yīng)速率的方向相反,且滿足速率之比是相應(yīng)的化學(xué)計(jì)量數(shù)之比,正確,所以答案選bc。
(4)增大反應(yīng)物的濃度,平衡向正反應(yīng)方向移動(dòng)。但由于反應(yīng)前后體積不變的,且CO和水蒸氣額物質(zhì)的量之比還是1︰1的,所以平衡是等效的,因此氫氣的含量不變。
(5)由于反應(yīng)前后體積不變,在平衡是等效的,但平衡時(shí)各種物質(zhì)的濃度均減半,所以圖像為(見(jiàn)答案)。



| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:
| 0min | 10min | 20min | 30min | 40min | 50min | |
| 830℃ | 1mol | 0.8mol | 0.65mol | 0.55mol | 0.5mol | 0.5mol |
| 1100℃ | 1mol | 0.75mol | 0.6mol | 0.6mol | 0.6mol | 0.6mol |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源:2011-2012學(xué)年四川省成都七中高二下學(xué)期期中考試化學(xué)試卷(帶解析) 題型:填空題
在體積為1L的兩個(gè)恒容密閉容器中,分別充入1molCO和1molH2O(g)的混合氣體,進(jìn)行如下化學(xué)反應(yīng):CO(g)+H2O(g) CO2(g)+H2(g),反應(yīng)物CO的物質(zhì)的量在不同溫度時(shí)物質(zhì)的量隨時(shí)間的變化如下表所示,回答下列問(wèn)題:
CO2(g)+H2(g),反應(yīng)物CO的物質(zhì)的量在不同溫度時(shí)物質(zhì)的量隨時(shí)間的變化如下表所示,回答下列問(wèn)題:
| | 0min | 10min | 20min | 30min | 40min | 50min |
| 830℃ | 1mol | 0.8mol | 0.65mol | 0.55mol | 0.5mol | 0.5mol |
| 1100℃ | 1mol | 0.75mol | 0.6mol | 0.6mol | 0.6mol | 0.6mol |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源:2012-2013學(xué)年江西省高安中學(xué)高二上學(xué)期期末考試化學(xué)試卷(帶解析) 題型:填空題
(共12分)隨著人類(lèi)對(duì)溫室效應(yīng)和資源短缺等問(wèn)題的重視,如何降低大氣中CO2的含量及有效地開(kāi)發(fā)利用CO2,引起了各國(guó)的普遍重視。
Ⅰ.目前工業(yè)上有一種方法是用CO2來(lái)生產(chǎn)燃料甲醇。為探究該反應(yīng)原理,進(jìn)行如下實(shí)驗(yàn),在體積為1L的密閉容器中,充入1mol CO2和3.25 mol H2,在一定條件下發(fā)生反應(yīng),測(cè)定CO2、CH3OH(g)和H2O(g)的濃度隨時(shí)間變化如下圖所示:
(1)從反應(yīng)開(kāi)始到平衡,氫氣的平均反應(yīng)速率 = mol/(L·min)
= mol/(L·min)
(2)該條件下CO2的轉(zhuǎn)化率為 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
| A.升高溫度 | B.恒容時(shí)充入氮?dú)?/td> |
| C.將水蒸氣從體系中分離 | D.用更有效的催化劑 |

查看答案和解析>>
科目:高中化學(xué) 來(lái)源:2011-2012學(xué)年四川省成都七中高二(下)期中化學(xué)試卷(解析版) 題型:解答題
| 0min | 10min | 20min | 30min | 40min | 50min | |
| 830℃ | 1mol | 0.8mol | 0.65mol | 0.55mol | 0.5mol | 0.5mol |
| 1100℃ | 1mol | 0.75mol | 0.6mol | 0.6mol | 0.6mol | 0.6mol |

查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專(zhuān)區(qū) | 電信詐騙舉報(bào)專(zhuān)區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專(zhuān)區(qū) | 涉企侵權(quán)舉報(bào)專(zhuān)區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com