
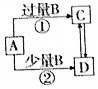
| A. | 若A為AlCl3溶液,B 可能為氨水,反應①的離子方程式為Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 若A為Fe,B可能為稀HNO3,反應②的離子方程式為3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| C. | 若A為NaOH溶液,B可能為CO2,可用Ca(OH)2溶液鑒定C、D 溶液中的陰離子 | |
| D. | 若A為Cl2,B可能為NH3,實驗室可用加熱固體C的方法制取NH3 |
分析 A.氨水為不能溶解氫氧化鋁,二者反應生成氫氧化鋁沉淀;
B.稀硝酸少量,反應生成硝酸亞鐵、水和NO氣體;
C.二氧化碳過量時生成的C為碳酸氫鈉,二氧化碳少量時生成的D為碳酸鈉,碳酸鈉和碳酸氫鈉都與氫氧化鈣反應;
D.若A為Cl2,B可能為NH3,則C為氯化銨,氨氣與氯化氫能夠反應生成氯化銨,無法據此制取氨氣.
解答 解:A.氯化鋁與氨水反應生成氫氧化鋁沉淀,正確的離子方程式為:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A錯誤;
B.若A為Fe,B可能為稀HNO3,反應生成硝酸亞鐵,反應的離子方程式為:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故B正確;
C.若A為NaOH溶液,B可能為CO2,C為碳酸氫鈉,D為碳酸鈉,碳酸鈉和碳酸氫鈉都與氫氧化鈣溶液反應生成碳酸鈣沉淀,無法用Ca(OH)2溶液鑒定,故C錯誤;
D.若A為Cl2,B可能為NH3,固體C為氯化銨,由于氨氣與氯化氫反應,無法通過加熱氯化銨的方法制取NH3,故D錯誤;
故選B.
點評 本題考查離子方程式書寫、氣體制備及離子檢驗等知識,為高考的高頻題,題目難度中等,注意掌握離子方程式的書寫原則,明確氨氣的制備方法、離子的檢驗原理等知識,試題培養了學生的靈活應用能力.


 導學教程高中新課標系列答案
導學教程高中新課標系列答案 小學課時特訓系列答案
小學課時特訓系列答案科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol FeI2與足量氯氣反應時轉移的電子數為2NA | |
| B. | 含4.9 g H2SO4與4.9 g H3PO4的混合溶液中氧原子數為0.4NA | |
| C. | 常溫下,0.1 mol C2H4分子中含共用電子對數目為0.6NA | |
| D. | 25℃時,Ksp(BaSO4)=1×10-10,則BaSO4飽和溶液中Ba2+數目為1×10-5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵制品在潮濕空氣中更易銹蝕 | |
| B. | 二氧化硅常用于制造光導纖維 | |
| C. | 實驗室中經過濾可得到納米碳酸鈣固體 | |
| D. | 聚乙烯可作食品包裝材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2NaOH+H2SO4═Na2SO4+2H2O | B. | 2SO2+O2+2H2O═2H2SO4 | ||
| C. | Cu+2H2SO4$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O | D. | C+2H2SO4(濃)$\frac{\underline{\;△\;}}{\;}$2SO2↑+CO2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
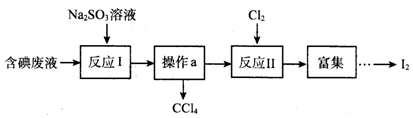
| A. | 操作a的名稱為蒸餾 | |
| B. | 反應I、II中碘元素均被氧化 | |
| C. | 還原性強弱順序:SO32->I->Cl- | |
| D. | 若反應I消耗25.2g Na2SO3,則反應II消耗標準狀況下氯氣的體積為4.48L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將Al2O3固體粉末加到沸水中 | |
| B. | 將CO2氣體不斷通人到NaAlO2溶液中 | |
| C. | 將過量的金屬鈉投入到NaAlO2溶液中 | |
| D. | 向340ml 1mol/L NaOH溶液中加入80ml 1mol/L的AlCl3溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com