
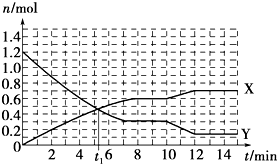
| A. | t1min時正、逆反應速率相等 | |
| B. | X曲線表示NH3的物質的量隨時間變化的關系 | |
| C. | 0~8 min,H2的平均反應速率v(H2)=0.75 mol•L-1•min-1 | |
| D. | 10~12 min,N2的平均反應速率為v(N2)=0.25mol•L-1•min-1 |
分析 根據圖知,隨著反應的進行,X的物質的量增大、Y的物質的量減少,反應達到平衡狀態(tài)時,X、Y的物質的量變化量分別為:△n(X)=(0.6-0)mol=0.6mol,△n(Y)=(1.2-0.3)mol=0.9mol,則X、Y的物質的量變化量之比等于其計量數之比=0.6mol:0.9mol=2:3,則X是NH3、Y是H2,
A.可逆反應達到平衡狀態(tài)時正逆反應速率相等,沒有達到平衡狀態(tài)時正逆反應速率不等;
B.根據以上分析知,X表示NH3;
C.0~8 min,H2的平均反應速率v(H2)=$\frac{\frac{0.9mol}{10L}}{8min}$;
D.10~12 min,NH3的平均反應速率v(NH3)=$\frac{\frac{(0.7-0.6)mol}{10L}}{(12-10)min}$=0.005mol•L-1•min-1,再根據同一可逆反應中同一時間段內各物質的反應速率之比等于其計量數之比計算氮氣反應速率.
解答 解:根據圖知,隨著反應的進行,X的物質的量增大、Y的物質的量減少,反應達到平衡狀態(tài)時,X、Y的物質的量變化量分別為:△n(X)=(0.6-0)mol=0.6mol,△n(Y)=(1.2-0.3)mol=0.9mol,則X、Y的物質的量變化量之比等于其計量數之比=0.6mol:0.9mol=2:3,則X是NH3、Y是H2,
A.可逆反應達到平衡狀態(tài)時正逆反應速率相等,沒有達到平衡狀態(tài)時正逆反應速率不等,根據圖知,t1min時該反應沒有達到平衡狀態(tài),所以正逆反應速率不等,故A錯誤;
B.根據以上分析知,X曲線表示NH3的物質的量隨時間變化的關系,故B正確;
C.0~8 min,H2的平均反應速率v(H2)=$\frac{\frac{0.9mol}{10L}}{8min}$=0.01125mol•L-1•min-1,故C錯誤;
D.10~12 min,NH3的平均反應速率v(NH3)=$\frac{\frac{(0.7-0.6)mol}{10L}}{(12-10)min}$=0.005mol•L-1•min-1,再根據同一可逆反應中同一時間段內各物質的反應速率之比等于其計量數之比計算氮氣反應速率為0.0025mol•L-1•min-1,故D錯誤;
故選B.
點評 本題考查圖象分析,為高頻考點,側重考查學生分析計算能力及識圖能力,易錯選項是A.注意:各物質的物質的量相等狀態(tài)不一定是化學平衡狀態(tài),為易錯點.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
 某校研究性學習小組的同學學習完氮的有關物質的性質之后,對氮元素的氫化物NH3性質的探究.
某校研究性學習小組的同學學習完氮的有關物質的性質之后,對氮元素的氫化物NH3性質的探究.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯化鈉溶液能導電,所以氯化鈉溶液是電解質 | |
| B. | 氯化鈉固體不導電,所以氯化鈉不是電解質 | |
| C. | 氯化氫溶液能導電,所以氯化氫是電解質 | |
| D. | 氯氣溶于水能導電,所以氯氣是電解質 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


 .
. +(2n-1)H2O.
+(2n-1)H2O. (寫出其中一種結構簡式).
(寫出其中一種結構簡式). )的合成路線示意圖.
)的合成路線示意圖.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 室溫下向10mL 0.1mol/L NaOH 溶液中加入0.1mol/L 的一元酸HA 溶液pH 的變化曲線如圖所示.下列說法正確的是( )
室溫下向10mL 0.1mol/L NaOH 溶液中加入0.1mol/L 的一元酸HA 溶液pH 的變化曲線如圖所示.下列說法正確的是( )| A. | a 點所示溶液中c(A-)+c(HA)=0.1mol/L | |
| B. | a、b 兩點所示溶液中水的電離程度不同 | |
| C. | pH=7 時,c(Na+)=c(A-)+c(HA) | |
| D. | b 點所示溶液中c(HA)>c(A-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學鍵是一種靜電引力 | |
| B. | 化學鍵可以使離子結合,也可以使原子結合 | |
| C. | 只要有舊健的斷裂就一定是化學反應 | |
| D. | 氫鍵是一種化學鍵 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com