
(9分)硫代硫酸鈉( Na2S2O3)可用做分析試劑及鞣革還原劑。它受熱、遇酸易分解。工業上可用反應:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得。實驗室模擬該工業過程的裝置如圖所示。
回答下列問題:
(1)b中反應的離子方程式為__________________,c中試劑為_____________________。
(2)反應開始后,c中先有渾濁產生,后又變澄清。此渾濁物是____________________。
(3)d中的試劑為____________。
(4)實驗中要控制SO2生成速率,可以采取的措施有______________________(寫出兩條)。
(5)為了保證硫代硫酸鈉的產量,實驗中通入的SO2,不能過量,原因是_______________________。
(1)SO32-+2H+= H2O +SO2↑;或HSO3-+H+=SO2↑+H2O;硫化鈉和碳酸鈉的混合溶液
(2)硫(3)NaOH溶液 (4)控制反應溫度、調節酸的滴加速度(或調節酸的濃度等)
(5)若SO2過量,溶液顯酸性,產物分解
解析試題分析:(1)裝置b是制取SO2的裝置。在b中反應的離子方程式為SO32-+2H+= H2O +SO2↑;或HSO3-+H+=SO2↑+H2O;根據反應原理可知在c中的試劑是硫化鈉和碳酸鈉的混合溶液。(2)反應開始后,c中先發生反應:H2O+SO2+Na2S=H2S+ Na2SO3; SO2+2H2S="3S↓+" 2H2O.S是不溶于水的淡黃色物質。因此有渾濁產生,后又變澄清,發生反應:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2。(3) H2S 、SO2都是大氣污染物。由于它們都是酸性氣體,能夠與堿發生反應,所以在d中的試劑為強堿NaOH溶液。為防止倒吸現象的發生,在導氣管的末端安裝了一個干燥管。(4)影響化學反應速率的因素的因素有濃度、溫度、滴加速度等。在實驗中要控制SO2生成速率,可以采取的措施有控制反應溫度、調節酸的滴加速度或調節酸的濃度等。(5)硫代硫酸鈉( Na2S2O3)是強堿弱酸鹽,與酸容易發生反應。所以若SO2過量,溶液顯酸性,產物容易分解。因此不能過量。
考點:考查物質的制備原理、反應條件的控制、試劑的選擇、現象的描述、方程式的書寫的知識。


 快捷英語周周練系列答案
快捷英語周周練系列答案科目:高中化學 來源: 題型:單選題
下述實驗能達到預期目的的是
| 編號 | 實驗內容 | 實驗目的 |
| A | 將CO2(含HC1雜質)通入飽和NaHCO3溶液中 | 除去HC1 |
| B | 向做完銀鏡反應后的試管中加入稀氨水 | 除去試管內殘留物 |
| C | 向做完淀粉水解后的溶液中直接加入新制的Cu(OH)2,并加熱 | 檢驗淀粉是否水解 |
| D | 將少量FeC12試樣加水溶解,加稀硝酸酸化,再滴加KSCN溶液 | 檢驗FeCl2是否變質 |
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(14分)硒(34Se)和碲(52Te)都是第VIA族元素,硒是分布在地殼中的稀有元素。工業上硒鼓廢料(主要成分硒、碲、碳、銅和鐵合金)回收精煉硒的流程如下: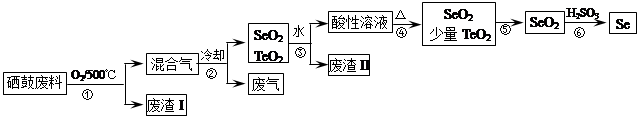
已知:
| 物理性質 | 熔點 | 沸點 | 升華 | 溶解性 |
| SeO2 | 340℃ | 684℃ | 315℃ | 易溶于水 |
| TeO2 | 733℃ | 1260℃ | 450℃ | 微溶于水 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
葡萄糖酸鈣是一種可促進骨骼生長的營養物質。葡萄糖酸鈣可通過以下反應制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸鈣)+H2O+CO2
相關物質的溶解性見下表:
| 物質名稱 | 葡萄糖酸鈣 | 葡萄糖酸 | 溴化鈣 | 氯化鈣 |
| 水中的溶解性 | 可溶于冷水 易溶于熱水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

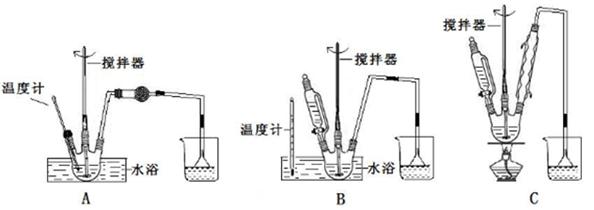
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
(16分)某化學興趣小組在進行鈉在空氣中燃燒的實驗,請寫出鈉在氧氣中燃燒的化學方程式: 。實驗后,同學們發現除了得到黃色物質外,產物中還有黑色物質。興趣小組的同學對產生的黑色固體物質進行實驗探究。
查閱資料:
工業上采用鐵環作陰極電解得到金屬鈉。實驗室中金屬鈉的標簽主要內容如下: 
提出猜想:
猜想1:鈉附著煤油,煤油的不完全燃燒可以生成碳單質;猜想2: 與鈉反應也可以生成碳單質;
猜想3: ; 猜想4:……
設計實驗方案,驗證猜想:
| 實驗目的 | 實驗步驟 | 實驗現象 | 結論 |
| 驗證猜想1 | 將一小塊鈉從煤油中直接取出加熱燃燒 取出一小塊切去表皮并擦干凈煤油的鈉加熱燃燒 | | 黑色物質中含 有碳單質 |
| 驗證猜想3 | | | 黑色物質中 含有鐵元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
飽和氯水與石灰石反應是制取較濃HClO溶液的方法之一。某興趣小組進行了如下實驗探究。
實驗一:定性研究。
①在試管中加入過量的塊狀碳酸鈣,再加入約20 mL飽和氯水(如圖所示),充分反應,有少量氣泡產生,溶液淺黃綠色退去;
②過濾,將濾液滴在有色布條上,發現濾液比氯水的漂白性更強;
③為了確定反應產物,將濾液分為三份,分別進行以下實驗:
第一份與石灰水混合,立即產生大量白色沉淀;
第二份與稀鹽酸混合,立即產生大量無色氣體;
第三份濾液加熱,看到濾液變渾濁且有大量無色氣體產生。經檢測,上述實驗中產生的無色氣體均為CO2。
請回答:
(1)反應后所得的溶液漂白性比氯水強的原因是 。
(2)依據上述實驗可推知:濾液中的溶質除CaCl2、HClO外,還有 (填寫溶質的化學式)。
實驗二:定量研究。
在圓底燒瓶底部,用一塑料網包住塊狀石灰石(過量)與150 mL飽和氯水反應,按下圖所示裝置實驗,待不再產生氣泡后,將塑料網中剩余的石灰石提出液面,將裝置密封后再加熱,煮沸燒瓶中的液體,量筒中的氣體不再增加時停止實驗。
請回答:
(3)實驗結束后檢測到量筒中收集到的氣體除CO2外還有O2,請寫出Ⅰ中產生O2的化學反應方程式 。
(4)為減少用裝置Ⅲ收集氣體過程中CO2因溶解而造成的損失,請你對裝置Ⅲ進行改進(水槽中仍為水),最簡單的方法是 。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
(20分)某研究性學習小組在實驗室中配制0.20mol·L-1的鹽酸標準溶液,然后用其滴定某未知濃度的氫氧化鈉溶液。
⑴配制待測液:將1.7 g含有少量雜質(不與鹽酸反應)的固體燒堿樣品配制成200 mL溶液,所需的主要玻璃儀器除燒杯,200 mL容量瓶,量筒,還有 ﹑ 。
⑵滴定:
①盛裝0.20mol·L-1鹽酸標準液應該用 式滴定管,
②滴定時,先向錐型瓶中加酚酞作為指示劑;再逐滴滴定,觀察到 時為滴定終點。
③有關數據記錄如下:
| 滴定序號 | 待測液體體積(mL) | 所耗鹽酸標準液的體積(mL) | |
| 起始讀數 滴定前 | 終點讀數 | ||
| 1 | 20.00 | 0.50 | 20.40 |
| 2 | 20.00 | 6.00 | 26.10 |
| 3 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
工業上用活性炭吸附海帶提碘后廢水中的I-制取I2,其流程如下圖: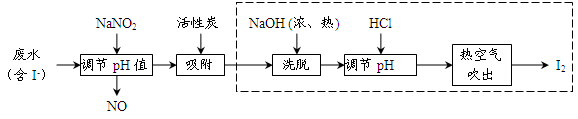
(1)向廢水中加入NaNO2并調節pH<4,寫出反應的離子方程式__________________。
(2)用活性炭吸附生成的單質碘的目的是__________________________,用濃、熱NaOH洗脫吸附的碘的化學方程式為___________________________________。
(3)從調節pH后所得的溶液中獲取碘,工業上可用熱空氣吹出,其原因是___________;若取少量該溶液在實驗室中分離得到單質碘,需要進行的操作為__________________。
(4)流程中生成的NO尾氣有毒,工業上將其與O2按一定比例通入NaOH制備NaNO2,寫出反應的化學方程式:________________________________。
(5)工業上虛框內流程還可用如圖操作代替,評價下圖流程的優點___________________________(寫出一條)。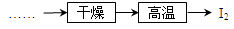
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
現有A、B、C、D、E五種易溶于水的強電解質,它們由如下離子組成(各種離子不重復)。
| 陽離子 | H+、NH4+、Mg2+、Ba2+、Al3+ |
| 陰離子 | OH-、Cl-、HCO3-、NO3-、SO42- |
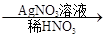 白色沉淀。請回答下列問題:
白色沉淀。請回答下列問題: 白色沉淀”有關反應的離子方程式____________________________。
白色沉淀”有關反應的離子方程式____________________________。| 實驗步驟 | 預期現象和結論 |
| 取適量C的溶液于試管中, ① 。 | 預期現象和結論1: ② ; 預期現象和結論2: ③ ; |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com