
將70g含過氧化鈉的氧化鈉的混合物跟98g水充分反應后,所得氫氧化鈉溶液的質量分數為50%。試分別寫出過氧化鈉和氧化鈉跟水反應的化學方程式,并計算原混合物中過氧化鈉和氧化鈉的質量各為多少?
本題可利用兩個化學方程并設兩個未知數求算。可設Na2O2、Na2O的質量分別為x,y,則:x+y=70①
利用化學方程式分別推導出各自與水反應生成NaOH的質量(用x或y的數學式表示),以及O2的質量(用x的數字式表示)。最后,根據溶質的質量分數公式及NaOH質量、NaOH溶液質量列出式②,兩式聯立,可求出x和y。
設原混合物中Na2O2的質量為x,Na2O的質量為y。
x+y=70 ①
2Na2O2+2H2O=4NaOH+O2↑
156 160 32
x ![]() x
x ![]() x
x
Na2O+H2O=2NaOH
62 80
y ![]() y
y
NaOH總質量為![]() x+
x+![]() y
y
NaOH溶液總質量為70+98-![]() x
x
根據溶液中溶質的質量分數公式: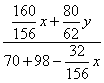 =0.5 ②
=0.5 ②
① ②聯立,解得:x=39 y=31
② Na2O2為39g,Na2O為31g


科目:高中化學 來源: 題型:
將70g含過氧化鈉的氧化鈉的混合物跟98g水充分反應后,所得氫氧化鈉溶液的質量分數為50%。試分別寫出過氧化鈉和氧化鈉跟水反應的化學方程式,并計算原混合物中過氧化鈉和氧化鈉的質量各為多少?
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com