
【題目】某有機物的結構簡式如下:
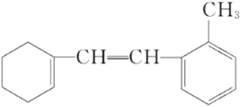
(1)該物質苯環上一氯代物有____________________種;
(2)1 mol該物質和溴水混合,消耗Br2的物質的量為____________________mol;
(3)1 mol該物質和H2加成最多需H2____________________mol;
(4)下列說法不正確的是____________________。
A.此物質可發生加成、取代、氧化等反應 |
B.該物質易溶于水 |
C.該物質能使溴水褪色 |
D.該物質能使酸性KMnO4溶液褪色 |
E.分子式是C15H18
【答案】(1)4
(2)2
(3)5
(4)B
【解析】試題分析:(1)根據有機物結構簡式可知苯環上的4個氫原子均不同,則該物質苯環上一氯代物有4種;
(2)碳碳雙鍵能與溴水反應,則1 mol該物質和溴水混合,消耗Br2的物質的量為2mol;
(3)苯環和碳碳雙鍵均能與氫氣發生加成反應,則1 mol該物質和H2加成最多需H25mol;
(4) A.含有碳碳雙鍵和苯環,此物質可發生加成、取代、氧化等反應等,A正確;B.烴類物質難溶于水水,B錯誤;C.碳碳雙鍵能與溴水發生加成反應,該物質能使溴水褪色,C正確;D.含有碳碳雙鍵和苯環,該物質能使酸性KMnO4溶液褪色,D正確;E.根據有機物結構簡式可知其分子式是C15H18,E正確,答案選B。


 暑假銜接教材期末暑假預習武漢出版社系列答案
暑假銜接教材期末暑假預習武漢出版社系列答案 假期作業暑假成長樂園新疆青少年出版社系列答案
假期作業暑假成長樂園新疆青少年出版社系列答案科目:高中化學 來源: 題型:
【題目】工業制得的氮化鋁(AlN)產品中常含有少量Al4C3、Al2O3、C等雜質。某同學設計如下實驗分別測定氮化鋁(AlN)樣品中AlN和Al4C3的質量分數。已知①Al4C3與硫酸反應可生成CH4;②AlN溶于強酸產生銨鹽,溶于強堿生成氨氣(忽略NH3在強堿性溶液中的溶解);③該實驗條件下的氣體摩爾體積為Vm L/mol,實驗裝置如下(量氣管為堿式滴定管改裝)
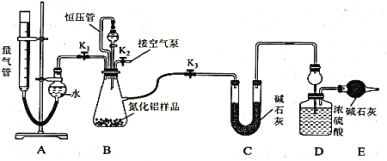
實驗過程:連好裝置后,檢驗裝置的氣密性;稱得裝置D的初始質量為ag;稱取bg AlN樣品置于裝置B的錐形瓶中,各裝置中加入相應藥品,重新連好裝置;讀取量氣管中液面的初始讀數為x mL(量氣裝置左右液面相平)。
(1)①若先測量Al4C3質量分數,對K1、K2、K3三個活塞的操作是關閉活塞______,打開活塞______。
②當_____時,說明反應已經結束。讀取讀數之前,應對量氣管進行的操作為____________;若量氣管中的液面高于右側球形容器中的液面,所測氣體體積______(填“偏大”、“偏小”或“無影響”)。
③記錄滴定管的讀數為y mL,則Al4C3的質量分數為_________(用可能含a、b、x、y、Vm的代數式表示)。
④若無恒壓管,對所測Al4C3質量分數的影響是______(填“偏大”、“偏小”或“無影響”)。
(2)若先測量AlN質量分數:首先關閉活塞K1,打開活塞K3,通過分液漏斗加入過量的某物質,寫出AlN與過量的某物質發生反應的離子方程式為__________;反應完成后,__________(填該步應進行的操作),最后稱得裝置D的質量為cg,進而測量AlN的質量分數。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】環氧乙烷常用于一次性口罩生產過程中滅菌和新冠病毒的消殺,工業上常利用乙烯直接氧化法生產環氧乙烷(![]() ),發生的反應如下。
),發生的反應如下。
主反應Ⅰ:2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) ΔH1=-210kJ·mol-1
(g) ΔH1=-210kJ·mol-1
副反應Ⅱ:CH2=CH2(g)+3O2(g)![]() 2CO2(g)+2H2O(l) ΔH2=-1324kJ·mol-1
2CO2(g)+2H2O(l) ΔH2=-1324kJ·mol-1
副反應Ⅲ:2![]() (g)+5O2(g)
(g)+5O2(g)![]() 4CO2(g)+4H2O(g) ΔH3
4CO2(g)+4H2O(g) ΔH3
已知:環氧乙烷選擇性是指乙烯進行反應Ⅰ生成環氧乙烷的優勢。
(1)ΔH3=__kJ·mol-1。
(2)①圖1是乙烯轉化率、環氧乙烷選擇性與流速關系的圖象,圖中隨進料氣的流速加快,乙烯的轉化率下降,其可能原因是__。
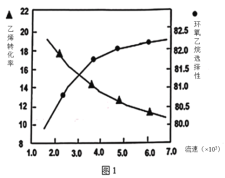
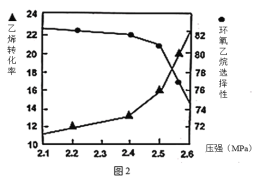
②圖2是乙烯轉化率、環氧乙烷選擇性與壓強關系的圖象,圖中當反應體系的壓強高于2.4MPa,環氧乙烷選擇性下降,其可能原因是__。
(3)實驗測得反應Ⅰ中,υ正=K正·x2(CH2=CH2)·x(O2),υ逆=K逆·x2(![]() ),(式中x為物質的量分數;K正、K逆為速率常數,只與溫度有關)。
),(式中x為物質的量分數;K正、K逆為速率常數,只與溫度有關)。
①若在1L的密閉容器中充2molCH2=CH2(g)和1molO2(g),在一定溫度下只發生反應I,達到平衡時CH2=CH2的轉化率為75%,則該反應平衡常數的值為__。
②若平衡后僅升高溫度,則下列說法正確的是___。
A.x(CH2=CH2)增大,x(![]() )減小
)減小
B.K正與K逆的比值增大
C.υ正減小,υ逆增大
D.K正與K逆的比值減小
(4)將乙烯與飽和食鹽水的電解產物反應,轉化為氯乙醇[CH2(OH)CH2Cl],氯乙醇進一步反應生成環氧乙烷,其電解簡易裝置如圖所示。
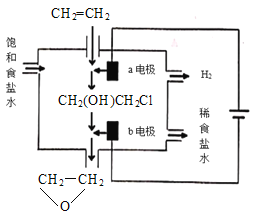
已知:CH2=CH2+H2O+Cl2→CH2(OH)CH2Cl+HCl
①a電極為__(選填“陰極”或“陽極”),其電極反應式為:__。
②b電極區域生成環氧乙烷的化學方程式為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】W、X、Y、Z為原子序數依次減小的短周期主族元素,已知W、Y、Z的最外層電子數之和等于X的最外層電子數;由四種元素形成某化合物的結構如圖所示。下列敘述正確的是

A.簡單氫化物的穩定性:Y>X
B.簡單離子半徑:X>W
C.Y的最高價氧化物對應水化物為強酸
D.該化合物中各元素均滿足8電子穩定結構
查看答案和解析>>
科目:高中化學 來源: 題型:
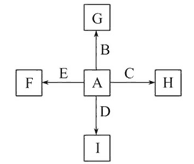
【題目】如圖中,A、B、C、D、E是單質,G、H、I、F是B、C、D、E分別和A形成的二元化合物。已知:
①反應C+G![]() B+H能放出大量的熱,該反應曾應用于鐵軌的焊接;
B+H能放出大量的熱,該反應曾應用于鐵軌的焊接;
②I是一種常見的溫室氣體,它和E可以發生反應:2E+I![]() 2F+D,F中E元素的質量分數為60%。
2F+D,F中E元素的質量分數為60%。
回答問題:
(1)①中反應的化學方程式為:________________________________________;
(2)1.6 g G溶于鹽酸,得到的溶液與銅粉完全反應,計算至少需銅粉的質量(寫出離子方程式和計算過程);__________________________________________。
(3)C與過量NaOH溶液反應的離子方程式為:___________________________,反應后溶液與過量化合物I反應的離子方程式為:_________________________;
(4)E在I中燃燒觀察到的現象是:____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2008年,三鹿等多家乳制品企業為使蛋白質含量檢測合格而加入三聚氰胺,使多名兒童患腎結石,實驗室可用下列實驗裝置測定三聚氰胺的分子式。
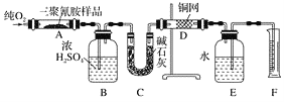
已知三聚氰胺的相對分子質量為126。取1.26 g三聚氰胺樣品,放在純氧中充分燃燒,生成二氧化碳、水、氮氣,實驗測得裝置B增重0.54g,C增重1.32g,排入F中水的體積為672 mL(可按標準狀況計算)。
(1)E裝置的作用是_____。
(2)需要加熱的裝置是____(填字母代號)。
(3)裝置D的作用是_____。
(4)F處讀數時應該注意的是____、_____。
(5)三聚氰胺的分子式為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
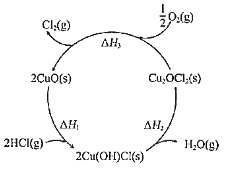
【題目】近年來,隨著聚酯工業的快速發展,氯氣的需求量和氯化氫的產出量也隨之迅速增長。因此,將氯化氫轉化為氯氣的技術成為科學研究的熱點。請回答:
(1)如圖表示在CuO存在下HCl催化氧化的反應過程,則總反應的化學方程為______。
(2)研究HCl催化氧化反應中溫度、![]() 和
和![]() 等因素對HCl轉化率的影響,得到如下實驗結果:
等因素對HCl轉化率的影響,得到如下實驗結果:
①利用Na2S2O3溶液和KI溶液測定反應生成Cl2的物質的量,若消耗V1mLc1mol·L-1的Na2S2O3溶液,則生成Cl2____________mol(已知2S2O![]() +I2=S4O
+I2=S4O![]() +2I-)。
+2I-)。
②![]() 表示催化劑的質量與HCl(g)流速之比,是衡量反應氣體與催化劑接觸情況的物理量。當
表示催化劑的質量與HCl(g)流速之比,是衡量反應氣體與催化劑接觸情況的物理量。當![]() =4、
=4、![]() =50g·min·mol-1時,每分鐘流經1g催化劑的氣體體積為_____L(折算為標準狀況下)。
=50g·min·mol-1時,每分鐘流經1g催化劑的氣體體積為_____L(折算為標準狀況下)。
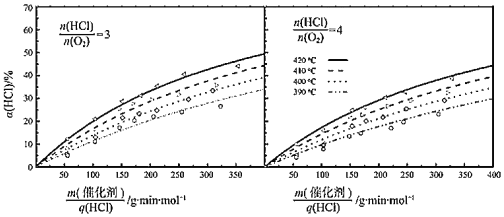
③在420℃、![]() =3、
=3、![]() =200g·min·mol-1條件下,α(HCl)為33.3%,則O2的反應速率為_______mol·g-1·min-1。
=200g·min·mol-1條件下,α(HCl)為33.3%,則O2的反應速率為_______mol·g-1·min-1。
④比較在下列兩種反應條件下O2的反應速率:vⅠ_______vⅡ(填“>”“=”或“<”)。
Ⅰ.410℃、![]() =3、
=3、![]() =350g·min·mol-1;
=350g·min·mol-1;
Ⅱ.390℃、![]() =4、
=4、![]() =350g·min·mol-1。
=350g·min·mol-1。
(3)在101.325kPa時,以含N2的HCl和O2的混合氣體測定不同溫度下HCl催化氧化反應中HCl的平衡轉化率,得到如圖結果
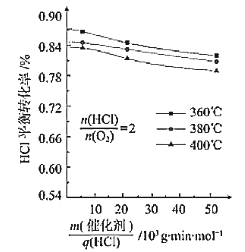
①360℃時反應的平衡常數K360與400℃時反應的平衡常數K400之間的關系是K360_________K400。(填“>”“=”或“<”)。
②一定溫度下隨著![]() 的增大,HCl的平衡轉化率_______(填“增大”“減小”或“不變”),原因為___________________。
的增大,HCl的平衡轉化率_______(填“增大”“減小”或“不變”),原因為___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組利用H2C2O4溶液和酸性KMnO4溶液之間的反應來探究“外界條件改變對化學反應速率的影響”,實驗如下:(不考慮溶液混合所引起的體積縮小)
實驗 序號 | 實驗溫度/K | 參加反應的物質 | 溶液顏色褪至無色時所需時間/s | ||||
KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(1)通過實驗A、B,可探究出濃度的改變對反應速率的影響,其中V1=_________,T1=_______;通過實驗___________可探究出溫度變化對化學反應速率的影響。
(2)C組實驗中液褪色時間t1______(填“>”或“<”)8s,C組實驗的反應速率v(KMnO4) = _________________。(用含有t1的式子表示)
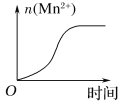
(3)該小組的一位同學通過查閱資料發現,上述實驗過程中n(Mn2+)隨時間變化的趨勢如圖所示,并以此分析造成n(Mn2+)突變的可能的原因是:______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用廢舊鍍鋅鐵皮可制備磁性Fe3O4膠體粒子及副產物ZnO,制備流程如下圖所示
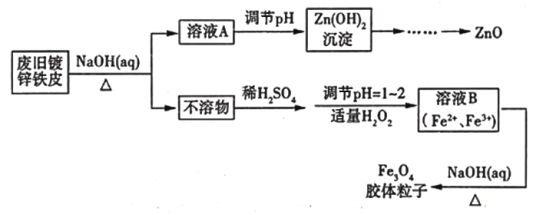
(1)從流程圖可知,Zn、Fe中能與NaOH溶液反應的是_______________________。
(2)向不溶物中加入稀硫酸發生反應的離子方程式是____________________________________。
(3)加入適量H2O2的目的是__________________________________。
(4)如何證明已生成了Fe3O4膠體?_____________________________________________________。
(5)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都轉化為硫酸,若將445g焦硫酸溶于水配成4.00L硫酸,該硫酸的物質的量濃度為__________________mol/L。
(6)稀硫酸也可以用濃硫酸和水配制。已知4 mol/L的硫酸溶液密度為ρ1g/cm3,2 mol/L的硫酸溶液密度為ρ2g/cm3。100g物質的量濃度為4 mol/L的硫酸溶液與___________mL水混合,使硫酸的物質的量濃度減小到2 mol/L(用含ρ1、ρ2的式子表示)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com