
Ⅰ 氮元素可以形成多種化合物。回答以下問題:
(1)基態氮原子的價電子排布圖是_________________。
(2)C、N、O 三種元素第一電離能從大到小的順序是____________。
(3)肼(N2H4)分子可視為NH3分子中的一個氫原子被-NH2(氨基)取代形成的另一種氮的氫化物。
①NH3分子的空間構型是_______________;N2H4分子中氮原子軌道的雜化類型是___________。
②肼可用作火箭燃料,燃燒時發生的反應是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若該反應中有4mol N-H 鍵斷裂,則形成的π 鍵有________mol。
Ⅱ 金屬鎳在電池、合金、催化劑等方面應用廣泛。
(4)第二周期基態原子未成對電子數與Ni相同且電負性最小的元素是______。
(5)甲醛(H2C=O)在Ni 催化作用下加氫可得甲醇(CH3OH)。甲醛分子內C 原子的雜化方式為________。
Ⅲ 氮可以形成多種離子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+與N2H62+是由中性分子結合質子形成的,類似于NH4+,因此有類似于 NH4+的性質。
(6)寫出N2H62+與堿溶液反應的離子方程式 ;
(7)寫出N3-等電子體物質的化學式 ;(一種)
(18分) (1)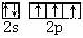 (2分) (2)N>O>C (2分)
(2分) (2)N>O>C (2分)
(3)①三角錐形(2分) sp3(2分) ②3(2分)
(4)C (2分) (5)sp2 (2分)
(6)N2H62++2OH-=N2H4+2H2O (2分) (7)N2O CO2 CNO- 等 (2分)
解析試題分析:Ⅰ(1)根據構造原理可知,基態氮原子的價電子排布圖是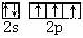 。
。
(2)非金屬性越強,第一電離能越大。但由于氮元素的2p軌道電子處于半充滿狀態,穩定性強,所以第一電離能大于氧元素的,則C、N、O三種元素第一電離能從大到小的順序是N>O>C。
(3)①氨氣分子中中心原子氮原子含有1對孤對電子,所以NH3分子的空間構型是三角錐型,NH3中氮原子軌道的雜化類型是sp3。而肼(N2H4)分子可視為NH3分子中的一個氫原子被—NH2(氨基)取代形成的,所以N2H4分子中氮原子軌道的雜化類型是sp3,這個與H2O,H2O2中O的雜化類型都是sp3的道理是一樣的。
②反應中有4mol N-H鍵斷裂,即有1molN2H4參加反應,生成1.5molN2,則形成的π鍵有3mol。
Ⅱ(4)Ni含有2對未成對電子,所以第二周期基態原子未成對電子數與Ni相同且電負性最小的元素是碳元素。
(5)甲醛是平面型結構,所以中心原子碳原子的雜化方式是sp2雜化。
Ⅲ(6)N2H62+與堿溶液反應類似于NH4+與堿液的反應,所以反應的方程式是N2H62++2OH-=N2H4+2H2O。
(7)原子數和價電子數分別都相等的是等電子體,則和N3-等電子體物質的化學式是N2O、CO2 、CNO- 等。
考點:考查核外電子排布式、軌道表達式、雜化軌道類型、分子空間結構、等電子體以及化學鍵的有關計算和判斷
點評:該題是高考中的常見題型,屬于中等難度的試題。試題綜合性強,側重對學生能力的培養和解題方法的指導與訓練,旨在考查學生靈活運用基礎知識解決實際問題的能力,有利于培養學生的邏輯推理能力和知識的遷移能力。該題以“周期表中的元素”為載體,考查學生對表中各元素性質和相應原子結構的周期性遞變規律的認識和掌握程度。考查了學生對物質結構與性質關系以及運用元素周期律解決具體化學問題的能力。


科目:高中化學 來源: 題型:
| ||


查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
 碳是形成化合物最多的元素.
碳是形成化合物最多的元素.
查看答案和解析>>
科目:高中化學 來源: 題型:
(1)該電中性的分子X的化學式是___________,電子式是_________。
(2)一個![]() 具有_____________個電子。
具有_____________個電子。
(3)寫出兩種由多原子組成的含有與![]() 電子數相同的微粒的化學式____________。
電子數相同的微粒的化學式____________。
(4)用電子式描述![]() 形成的過程。
形成的過程。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年江蘇省射陽中學高二上學期期末考試化學(選修)試卷 題型:填空題
碳是形成化合物種類最多的元素,氮元素可以形成多種化合物,氧是地殼中含量最多的元素。
回答以下問題:(12分,每空2分)
(1)“低碳生活”倡導低能量、低消耗,主要是為了減少 (填化學式)的排放量.
(2)基態氮原子的價電子排布式是_________ ________。
(3)氧元素基態原子核外未成對電子數為 個。
(4)C、N、O三種元素第一電離能從大到小的順序是____________。
(5)若某元素E的原子最外層電子排布為2s22 p1,某元素F的原子外圍電子排布為2s22p2,則元素E與元素F的電負性從大到小順序是_____ _______(用元素符號表示)。
元素F在元素周期表 區域(填s、p、d、ds、f區)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com