


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:

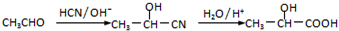
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、除③外 | B、除③⑤外 |
| C、除③④外 | D、除⑥外 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 第一電離能 | 離子半徑 | 熔點 | 酸性 |
| Si | O2-Na+ | NaCl | H2SO4 |
查看答案和解析>>
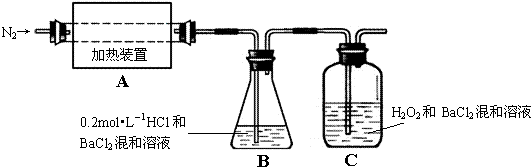
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | ||
| B、由水電離出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO3-、K+ | ||
C、
| ||
| D、c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、46 g NO2和N2O4混合氣體中含有原子總數為3NA |
| B、常溫下,Cu-Zn原電池中,正極產生1.12 L H2時,轉移的電子數應小于0.1NA |
| C、12 g金剛石中含有的共價鍵數為2NA |
| D、2.1 g DTO中所含中子數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、溫度不變時,增大反應物濃度可能增大活化分子的分子數 |
| B、其他條件不變時,升高溫度能使分子獲得更高的能量,活化分子百分數提高 |
| C、其他條件不變時,對于有氣體參與和生成的反應而言,縮小體積增大體系的壓強能增大單位體積內的活化分子百分數 |
| D、其他條件不變時,加人正催化劑能提高反應體系中含有的活化分子百分數 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com