
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2012-2013學年江蘇省南通市海安縣高二上學期期末考試化學試卷(帶解析) 題型:填空題
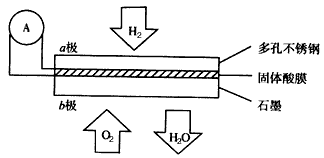
(14分)電化學原理在現代生產生活中有著重要應用。
⑴燃料電池是目前發展勢頭強勁的優秀綠色環保電池。某新型氫氧燃料電池以H2為燃料,O2為氧化劑,H2SO4溶液為電解液),寫出該電池的總反應方程式: 。
⑵鋁電池性能優越,Al—AgO電池可用作水下動力電源,該電池反應的原理為:
Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O。
①該電池反應的負極電極反應式 。
②圖中隔膜為陰離子交換膜,溶液中OH-通過向 極移動(選填“正”或“負”)。
用Al—AgO電池作為電源,使用Pt電極電解500mL飽和NaCl溶液,電解一段時間后,恢復至室溫,所得溶液pH=13(假設NaCl溶液足量且電解前后體積不變)。
③使用Pt電極電解NaCl溶液的離子方程式 ;
電解過程中放出氫氣的體積(標準狀況下)為 L。
④若電池的效率為50%,該過程中消耗金屬鋁的質量為 g。
⑶用電解法制取鎂時,若原料氯化鎂含有水時,在電解溫度下,原料會形成Mg(OH)Cl,并發生電離:Mg(OH)C1 = Mg(OH)+ + C1一。
電解時在陰極表面會產生氧化鎂鈍化膜,此時陰極的反應式為 。
查看答案和解析>>
科目:高中化學 來源:2014屆江蘇省南通市海安縣高二上學期期末考試化學試卷(解析版) 題型:填空題
(14分)電化學原理在現代生產生活中有著重要應用。
⑴燃料電池是目前發展勢頭強勁的優秀綠色環保電池。某新型氫氧燃料電池以H2為燃料,O2為氧化劑,H2SO4溶液為電解液),寫出該電池的總反應方程式: 。
⑵鋁電池性能優越,Al—AgO電池可用作水下動力電源,該電池反應的原理為:
Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O。

①該電池反應的負極電極反應式 。
②圖中隔膜為陰離子交換膜,溶液中OH-通過向 極移動(選填“正”或“負”)。
用Al—AgO電池作為電源,使用Pt電極電解500mL飽和NaCl溶液,電解一段時間后,恢復至室溫,所得溶液pH=13(假設NaCl溶液足量且電解前后體積不變)。
③使用Pt電極電解NaCl溶液的離子方程式 ;
電解過程中放出氫氣的體積(標準狀況下)為 L。
④若電池的效率為50%,該過程中消耗金屬鋁的質量為 g。
⑶用電解法制取鎂時,若原料氯化鎂含有水時,在電解溫度下,原料會形成Mg(OH)Cl,并發生電離:Mg(OH)C1 = Mg(OH)+ + C1一。
電解時在陰極表面會產生氧化鎂鈍化膜,此時陰極的反應式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
(1)航天技術上使用的氫―氧燃料電池具有高能、輕便和不污染環境等優點。氫―氧燃料電池有酸式和堿式兩種,它們放電時的電池總反應為: 2H2 + O2 = 2 H2O 。酸式氫―氧燃料電池的電解質是酸,其負極反應可表示為: 2H2 4e- = 4 H+,其正極反應表示為___________ ;堿式氫―氧燃料電池中的電解質是堿,其正極反應表示為: O2 +2H2O+4e-=4OH-,則其負極反應可表示為:
(2)鉛蓄電池是典型的可充型電池,它的正負極格板是惰性材料,正極板上覆蓋PbO2,
負極板上覆蓋Pb,電解質是硫酸。電池總反應式為:
Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O
2PbSO4+2H2O
請回答下列問題(不考慮氫、氧的氧化還原):
放電時:正極的電極反應式是__________________________
充電時:陰極的電極反應式是
(3)現代工業上主要采用離子交換膜法電解飽和食鹽水制取H2、Cl2、NaOH。請
回答下列問題:
①該過程總的離子反應方程式為:
電解之前,食鹽水需要精制,目的是除去粗鹽中的Ca2+、Mg2+、SO42-等雜質離子,使
用的試劑有:a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀鹽酸, 其合理的加入順序為
_________________(填試劑序號)。
②離子交換膜的作用是 。
 ③現設計一電解裝置如右圖,用離子交換膜A和B將電解槽分為I、II、
③現設計一電解裝置如右圖,用離子交換膜A和B將電解槽分為I、II、
Ⅲ三個區域,A為“陽離子交換膜”,它有一特殊的功能――只允許陽
離子通過,但阻止陰離子和氣體通過,而B是“陰離子交換膜”,它只
允許陰離子通過,可阻止陽離子和氣體通過,電極均為惰性電極。若在I區投入Na2SO4
溶液,通電電解。陰極的電極反應式為_____________________________,
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
(1)航天技術上使用的氫―氧燃料電池具有高能、輕便和不污染環境等優點。氫―氧燃料電池有酸式和堿式兩種,它們放電時的電池總反應為: 2H2 + O2 = 2 H2O 。酸式氫―氧燃料電池的電解質是酸,其負極反應可表示為: 2H2 4e- = 4 H+,其正極反應表示為___________ ;堿式氫―氧燃料電池中的電解質是堿,其正極反應表示為: O2 +2H2O+4e-=4OH-,則其負極反應可表示為:
(2)鉛蓄電池是典型的可充型電池,它的正負極格板是惰性材料,正極板上覆蓋PbO2,
負極板上覆蓋Pb,電解質是硫酸。電池總反應式為:
Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O
2PbSO4+2H2O
請回答下列問題(不考慮氫、氧的氧化還原):
放電時:正極的電極反應式是__________________________
充電時:陰極的電極反應式是
(3)現代工業上主要采用離子交換膜法電解飽和食鹽水制取H2、Cl2、NaOH。請
回答下列問題:
①該過程總的離子反應方程式為:
電解之前,食鹽水需要精制,目的是除去粗鹽中的Ca2+、Mg2+、SO42-等雜質離子,使
用的試劑有:a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀鹽酸, 其合理的加入順序為
_________________(填試劑序號)。
②離子交換膜的作用是 。
 ③現設計一電解裝置如右圖,用離子交換膜A和B將電解槽分為I、II、
③現設計一電解裝置如右圖,用離子交換膜A和B將電解槽分為I、II、
Ⅲ三個區域,A為“陽離子交換膜”,它有一特殊的功能――只允許陽
離子通過,但阻止陰離子和氣體通過,而B是“陰離子交換膜”,它只
允許陰離子通過,可阻止陽離子和氣體通過,電極均為惰性電極。若在I區投入Na2SO4
溶液,通電電解。陰極的電極反應式為_____________________________,
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com