
將W1 g光亮的銅絲在空氣中加熱一段時間后,迅速插入下列物質中,取出干燥,如此反復幾次 ,最后取出銅絲用蒸餾水洗滌、干燥、稱得其質量為W2 g。實驗時由于所插入的物質不同,銅絲的前后質量變化可能不同,下列所插物質與銅絲的質量關系不正確的是
,最后取出銅絲用蒸餾水洗滌、干燥、稱得其質量為W2 g。實驗時由于所插入的物質不同,銅絲的前后質量變化可能不同,下列所插物質與銅絲的質量關系不正確的是
A.石灰水 W1 <W2 B.CO W1 = W2
C.NaHSO4 W1 >W2 D.乙醇溶液 W1 <W2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源:2016屆廣西桂林市高三第一次月考化學試卷(解析版) 題型:選擇題
用NA表示阿伏加德羅常數,下列說法正確的是
① 18g D2O含有的電子數為10NA;
② 1mol Na2O2與水完全反應時轉移電子數為2NA ;
③ 12g石墨烯(單層石墨)中含有六元環的個數為0.5NA;
④ 在標準狀況下,22.4LSO3的物質的量為1mol;
⑤ 7.8g過氧化鈉中含有的離子數為0.3NA;
⑥ 28g 硅晶體中含有2NA個Si—Si鍵
⑦ 200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-離子數的總和是NA
⑧ 在常溫常壓下,0.1mol鐵與0.1molCl2充分反應,轉移的電子數為0.3NA
⑨ 標準狀況下,22.4LNO和11.2LO2混合后氣體的分子總數為1.5NA
⑩ S2和S8的混合物共6.4g,其中所含硫原子數一定為0.2NA
A、①③⑤⑧ B、②④⑥⑦ C、③⑤⑥⑩ D、⑤⑧⑨⑩
查看答案和解析>>
科目:高中化學 來源:2016屆山東省新高三開學初模擬檢測化學試卷(解析版) 題型:選擇題
鎂鐵混合物13.8g溶解在足量某濃度的稀硝酸中,完全反應,其還原產物只有一氧化氮(0.3mol),則向反應后的溶液中加入足量的NaOH溶液,可生成的沉淀質量為
A.26 B.29.1g C.29.5g D.24g
查看答案和解析>>
科目:高中化學 來源:2016屆江漢油田海南海政學校高三月考化學試卷(解析版) 題型:選擇題
將等物質的量的鎂和鋁混合,取等質量該混合物四份,分別加到足量的下列溶液中,充分反應后,放出氫氣最多的是
A.3 mol·L-1HCl B.4 mol·L-1HNO3
C.8 mol·L-1NaOH D.18 mol·L-1濃H2SO4
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省高三上學期起點考試化學試卷(解析版) 題型:填空題
(8 分)氯化鐵是常見的水處理劑,無水FeCl3 的熔點為282℃,沸點為315℃。工業上制備無水FeCl3 的一種工藝流程如下:
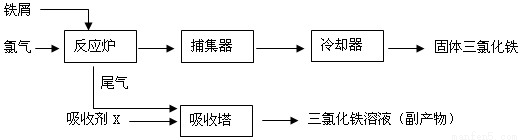
(1)氯化鐵能用作水處理劑的原因是_________________(用必要的文字和化學方程式說明)。
(2)吸收塔中吸收劑X 是_______。
(3)溫度超過400℃時,捕集器中捕集到的物質的相對分子質量為325,該物質的分子式為________。
(4)從副產物FeCl3 溶液中獲得FeCl3·6H2O 的方法是在滴加濃鹽酸后,________、________、過濾,洗滌、晾干。
(5)用FeCl3 溶液(32%~35%)腐蝕印刷線路板的廢液中含FeCl3、FeCl2 和CuCl2。用化學方法回收廢液中銅的方法是______________(用反應式表示并簡述操作要點)。
查看答案和解析>>
科目:高中化學 來源:2016屆重慶市高三7月月考化學試卷(解析版) 題型:填空題
(14分)亞硫酸鈉(Na2SO3)、漂白液(NaClO)和明礬[KAl(SO4)2?12H2O]都是重要的化工產品,在日常生活和工業生產中都有廣泛用途,且三者都可用在造紙業的不同生產工序中。
(1)NaClO做消毒液是它能與水反應產生一種強氧化性物質,寫出該強氧化性物質的電子式_______。在工業上,用氯化鈉為原料,在堿性溶液中,通過電解的方法可制得NaClO,用離子方程式表示制取NaClO的電解總反應:____________。將等濃度等體積的NaClO與Na2SO3溶液混合后,兩者恰好完全反應,寫出混合過程的離子反應方程式 ____________。
(2)將飽和NaClO和KAl(SO4)2溶液混合,置于一只帶單孔橡皮塞的大試管中,產生大量的白色膠狀沉淀。此時反應的離子方程為____________。再將大試管置于陽光下照射,不久試管液面上方有淺黃綠色氣體產生,將氣體通入NaOH溶液充分吸收后,還能收集到一種無色無味的氣體。寫出在陽光照射下,混合液中反應的化學方程式____________。
若將KAl(SO4)2溶液換成硫酸亞鐵銨【(NH4)2SO4?FeSO4】溶液后,再與NaClO溶液混合,觀察到大試管中有紅褐色沉淀產生,同時溶液里現黃色,但沒有氣體生成。此時試管中發生反應的離子方程式為______。
(3)取一定體積KAl(SO4)2溶液于試管中,逐滴加入一定濃度的Ba(OH)2溶液, 直至產生沉淀的質量最大,寫出此時的離子反應方程式____________。
查看答案和解析>>
科目:高中化學 來源:2016屆寧夏回族自治區銀川一中高三上學期第一次月考化學試卷(解析版) 題型:選擇題
下列反應的離子方程式正確的是
A.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
B.鈉與CuSO4溶液反應:2Na+Cu2+===Cu↓+2Na+
C.AlCl3溶液中加入過量稀氨水:Al3++4NH3·H2O AlO2- +4NH4+ +2H2O
AlO2- +4NH4+ +2H2O
D.用雙氧水和稀硫酸處理印刷電路板:Cu + H2O2 + 2H+ = Cu2+ + 2H2O
查看答案和解析>>
科目:高中化學 來源:2016屆黑龍江省高三上學期開學考試化學試卷(解析版) 題型:填空題
(共15分)利用芳香烴X和烯烴Y可以合成紫外線吸收劑BAD。已知:G不能發生銀鏡反應,B遇FeCl3溶液顯紫色,C到D的過程為引入羧基(—COOH)的反應。其中BAD結構簡式為:

BAD的合成路線如下:

試回答下列問題:
(1)寫出結構簡式:Y ,D 。
(2)上述屬于取代反應的有 (填數字序號)。
(3)1molBAD最多可與含 molNaOH的溶液完全反應。
(4)寫出方程式
反應④ 。
B+E 。
(5)E有多種同分異構體,判斷符合下列要求的同分異構體數目為 種。
①能發生銀鏡反應
②遇FeCl3溶液顯紫色
③核磁共振氫譜圖中有四個吸收峰
查看答案和解析>>
科目:高中化學 來源:2016屆河北省高三第一次月考化學試卷(解析版) 題型:填空題
(14分)工業上以黃銅礦(主要成分CuFeS2)為原料制備CuSO4·5H2O的主要流程如下:
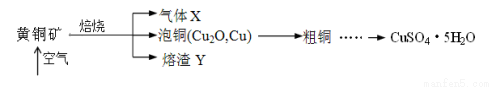
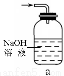
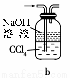
(1)下列裝置可用于吸收氣體X的是 (填代號)。

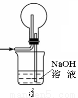
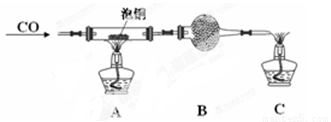
(2)某研究性學習小組用泡銅與CO反應來制取粗銅。
①裝置B中的藥品為 。
②實驗時,依次進行如下操作:組裝儀器、 、加裝藥品、通入氣體、 、點燃酒精燈。
(3)熔渣Y的成分為Fe2O3和FeO,選用提供的試劑,設計實驗驗證熔渣中含有FeO。寫出有關實驗操作、現象與結論。提供的試劑:稀鹽酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、氯水。
。
(4)向粗銅中加入硫酸和硝酸的混酸溶液制取硫酸銅時(雜質不參加反應),混酸中H2SO4與HNO3的最佳物質的量之比為 。
(5)用滴定法測定所得產品中CuSO4·5H2O的含量,稱取a g樣品配成100 mL溶液,取出20.00 mL,用c mol·L-1滴定劑 EDTA(H2Y2-)標準溶液滴定至終點(滴定劑不與雜質反應),消耗滴定劑b mL。滴定反應如下:Cu2+ + H2Y2-= CuY2-+ 2H+。則CuSO4·5H2O質量分數為________。滴定管用蒸餾水洗滌后,直接注入標準溶液,則會導致測定結果偏 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com