
(4分) 合成氨工業對國民經濟和社會發展具有重要的意義。向2L密閉容器中通入2mol 氣體N2和6mol氣體H2,在一定條件下發生反應:N2(g)+3H2(g) 2NH3(g);已知:反應2min達到平衡 ,此時N2的濃度減少了2/3。
回答下列問題:
⑴反應2min內,用NH3表示該反應的速率是________________;
⑵反應平衡時,N2的轉化率為 ;
⑶如果只升高反應溫度,其他反應條件不變,平衡時NH3濃度為 1.1 mol/L,則該反應的ΔH 0;(填“>”、“<”或“=”)
⑷合成氨工業采取的下列措施中,不能用勒沙特列原理解釋的是________(填序號)。
①20 MPa~50MPa ②500℃的高溫 ③鐵觸媒作催化劑
④將生成的氨液化并及時從體系中分離出來,未反應的N2、H2循環到合成塔中
⑸如果其他條件不變,將容器的容積變為 1L,進行同樣的實驗,則與上述反應比較:
反應速率 (填“增大”、“減小”或“不變”),理由是 ;
科目:高中化學 來源: 題型:閱讀理解
(12分)合成氨工業對國民經濟和社會發展具有重要的意義。其原理為:
N2(g)+3H2(g) 2NH3(g) △H= -92.4KJ/mol ,據此回答以下問題:
(1)下列有關該反應速率的敘述,正確的是(選填序號) 。
a.升高溫度可以增大活化分子百分數,加快反應速率
b.增大壓強不能增大活化分子百分數,所以不可以加快反應速率
c.使用催化劑可以使反應物分子平均能量升高,加快反應速率
d.在質量一定的情況下,催化劑顆粒的表面積大小,對反應速率有顯著影響
(2)①該反應的化學平衡常數表達式為K=_______________________。
②根據溫度對化學平衡的影響規律可知,對于該反應,溫度越高,其平衡常數的值越_____ 。
(3)某溫度下,若把10 mol N2與30 mol H2 置于體積為10 L的密閉容器內,反應達到平衡狀態時,測得平衡混合氣體中氨的體積分數為20%,則該溫度下反應的K=___________(可用分數表示)。能說明該反應達到化學平衡狀態的是 (填字母)。
a.容器內的密度保持不變 b.容器內壓強保持不變
c.υ正(N2)=2υ逆(NH3) d.混合氣體中 c(NH3)不變
(4)對于合成氨反應而言,下列有關圖象一定正確的是(選填序號)_____________。
(5)相同溫度下,有恒容密閉容器A和恒壓密閉容器B,兩容器中均充入1molN2和3 molH2,此時兩容器的體積相等。在一定條件下反應達到平衡狀態,A中NH3的體積分數為a,放出熱量Q1kJ;
B中NH3的體積分數為b,放出熱量Q2kJ。則:a_____b(填>、=、<), Q1_____Q2(填>、=、<), Q1_____92.4(填>、=、<)。
查看答案和解析>>
科目:高中化學 來源:2010年貴州冊亨民族中學高二上學期期末考試化學卷(理) 題型:填空題
(4分) 合成氨工業對國民經濟和社會發展具有重要的意義。向2L密閉容器中通入2mol 氣體N2和6mol氣體H2,在一定條件下發生反應:N2(g)+3H2(g)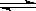 2NH3(g);已知:反應2min達到平衡,此時N2的濃度減少了2/3。
2NH3(g);已知:反應2min達到平衡,此時N2的濃度減少了2/3。
回答下列問題:
⑴反應2min內,用NH3表示該反應的速率是________________;
⑵反應平衡時,N2的轉化率為 ;
⑶如果只升高反應溫度,其他反應條件不變,平衡時NH3濃度為 1.1mol/L,則該反應的ΔH 0;(填“>”、“<”或“=”)
⑷合成氨工業采取的下列措施中,不能用勒沙特列原理解釋的是________(填序號)。
①20 MPa~50 MPa ②500℃的高溫 ③鐵觸媒作催化劑
④將生成的氨液化并及時從體系中分離出來,未反應的N2、H2循環到合成塔中
⑸如果其他條件不變,將容器的容積變為 1L,進行同樣的實驗,則與上述反應比較:
反應速率 (填“增大”、“減小”或“不變”),理由是 ;
查看答案和解析>>
科目:高中化學 來源:2010年貴州冊亨民族中學高二上學期期末考試化學卷(理) 題型:填空題
(4分) 合成氨工業對國民經濟和社會發展具有重要的意義。向2L密閉容器中通入2mol 氣體N2
和6mol氣體H2,在一定條件下發生反應:N2(g)+3H2(g) 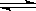 2NH3(g);已知:反應2min達到平衡 ,此時N2的濃度減少了2/3。
2NH3(g);已知:反應2min達到平衡 ,此時N2的濃度減少了2/3。
回答下列問題:
⑴反應2min內,用NH3表示該反應的速率是________________;
⑵反應平衡時,N2的轉化率為 ;
⑶如果只升高反應溫度,其他反應條件不變,平衡時NH3濃度為 1.1 mol/L,則該反應的ΔH 0;(填“>”、“<”或“=”)
⑷合成氨工業采取的下列措施中,不能用勒沙特列原理解釋的是________(填序號)。
①20 MPa~50 MPa ②500℃的高溫 ③鐵觸媒作催化劑
④將生成的氨液化并及時從體系中分離出來,未反應的N2、H2循環到合成塔中
⑸如果其他條件不變,將容器的容積變為 1L,進行同樣的實驗,則與上述反應比較:
反應速率 (填“增大”、“減小”或“不變”),理由是 ;
查看答案和解析>>
科目:高中化學 來源:2010年北京五中高二下學期期末考試化學試題 題型:填空題
(12分)合成氨工業對國民經濟和社會發展具有重要的意義。其原理為:
N2(g)+3H2(g)  2NH3(g) △H= -92.4KJ/mol ,據此回答以下問題:
2NH3(g) △H= -92.4KJ/mol ,據此回答以下問題:
(1)下列有關該反應速率的敘述,正確的是(選填序號) 。
a.升高溫度可以增大活化分子百分數,加快反應速率
b.增大壓強不能增大活化分子百分數,所以不可以加快反應速率
c.使用催化劑可以使反應物分子平均能量升高,加快反應速率
d.在質量一定的情況下,催化劑顆粒的表面積大小,對反應速率有顯著影響
(2)①該反應的化學平衡常數表達式為K=_______________________。
②根據溫度對化學平衡的影響規律可知,對于該反應,溫度越高,其平衡常數的值越_____ 。
(3)某溫度下,若把10 mol N2與30 mol H2 置于體積為10 L的密閉容器內,反應達到平衡狀態時,測得平衡混合氣體中氨的體積分數為20%,則該溫度下反應的K=___________(可用分數表示)。能說明該反應達到化學平衡狀態的是 (填字母)。
a.容器內的密度保持不變 b.容器內壓強保持不變
c.υ正(N2)=2υ逆(NH3) d.混合氣體中 c(NH3)不變
(4)對于合成氨反應而言,下列有關圖象一定正確的是(選填序號)_____________。
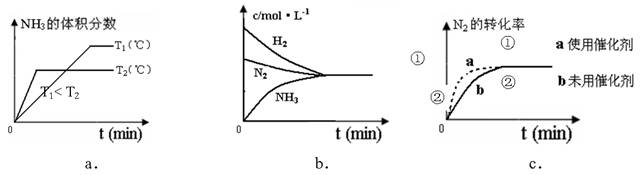
(5)相同溫度下,有恒容密閉容器A和恒壓密閉容器B,兩容器中均充入1mol N2和3 molH2,此時兩容器的體積相等。在一定條件下反應達到平衡狀態,A中NH3的體積分數為a,放出熱量Q1 kJ;
B中NH3的體積分數為b,放出熱量Q2 kJ。則:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com