
【題目】2℃時,向25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲線如圖所示。下列說法正確的是( )
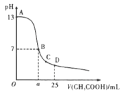
A.在A、B間任一點的溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.用含a的代數式表示CH3COOH的電離平衡常數K=![]()
C.C點對應的溶液中,水電離出的H+濃度大于10-7 mol/L
D.D點對應的溶液中,存在關系:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH-)
【答案】B
【解析】
A. 在接近A點處溶液中溶質為CH3COONa、NaOH,且c(NaOH)>c(CH3COONa),二者都是強電解質,根據物料守恒得c(CH3COO-)<c(OH-),A錯誤;
B. B點溶液呈中性,則c(OH-)>c(H+)=10-7 mol/L,根據電荷守恒得c(Na+)=c(CH3COO-)=![]() mol/L=
mol/L=![]() mol/L ,溶液中c(CH3COOH)=
mol/L ,溶液中c(CH3COOH)=![]() mol/L =
mol/L =![]() mol/L,電離平衡常數K=
mol/L,電離平衡常數K=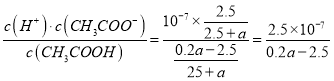 ,B正確;
,B正確;
C. C點溶液中溶質為醋酸鈉和醋酸,溶液pH<7,溶液呈酸性,說明醋酸的電離大于醋酸根離子的水解,酸的電離抑制水的電離,則水的出的H+濃度小于10-7 mol/L,C錯誤;
D. D點溶液的溶質是等濃度的醋酸和醋酸鈉溶液,溶液中存在電荷守恒:c(Na+) +c(H+)=c(CH3COO-)+c(OH-),存在物料守恒:2c(Na+)=c(CH3COO-)+c(CH3COOH),兩者聯立整理可得:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-),D錯誤;
故合理選項是B。


 寒假天地重慶出版社系列答案
寒假天地重慶出版社系列答案科目:高中化學 來源: 題型:
【題目】某同學用下列裝置制備并檢驗Cl2的性質。下列說法正確的是
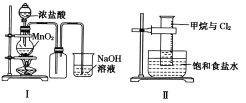
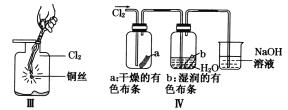
A. I圖中:如果MnO2過量,濃鹽酸就可全部被消耗
B. II圖中:量筒中發生了加成反應
C. III圖中:生成藍色的煙
D. IV圖中:濕潤的有色布條能褪色將硫酸溶液滴入燒杯中,至溶液顯酸性,結果有Cl2生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,利用 CO2 合成 CH3OH 的反應如下:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g)△H1,研究發現,反應過程中會有副反應:CO2(g) + H2(g)
CH3OH(g) + H2O(g)△H1,研究發現,反應過程中會有副反應:CO2(g) + H2(g)![]() CO(g) + H2O(g) △H2。溫度對 CH3OH、CO 的產率影響如圖所示。下列說法中,不正確的是
CO(g) + H2O(g) △H2。溫度對 CH3OH、CO 的產率影響如圖所示。下列說法中,不正確的是
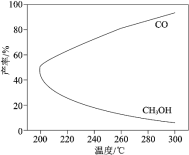
A.△H1 < 0,△H2 > 0
B.增大壓強可以縮短合成反應達到平衡所需的時間
C.生產過程中,溫度越高越有利于提高 CH3OH 的產率
D.合成 CH3OH 反應的平衡常數表達式是K=![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨是人類科學技術上的一項重大突破,其反應原理為:N2(g)+3H2(g)2NH3(g) △H=-92.4kJmol-1
一種工業合成氨的簡易流程圖如圖:
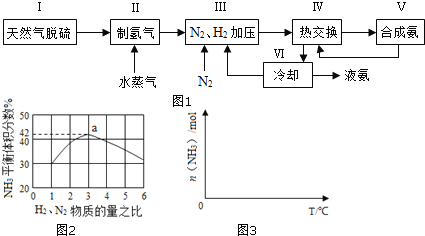
(1)天然氣中的H2S雜質常用常用氨水吸收,產物為NH4HS。一定條件下向NH4HS溶液中通入空氣,得到單質硫并使吸收液再生,寫出再生反應的化學方程式:___。
(2)步驟II中制氯氣原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJmol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJmol-1
對于反應①,一定可以提高平衡體系中H2百分含量,又能加快反應速率的是___。
a.升高溫度 b.增大水蒸氣濃度 c.加入催化劑 d.降低壓強
利用反應②,將CO進一步轉化,可提高H2產量。若1molCO和H2的混合氣體(CO的體積分數為20%)與H2O反應,得到1.18molCO、CO2和H2的混合氣體,則CO轉化率為___。
(3)圖2表示500℃、60.0MPa條件下,原料氣投料比與平衡時NH3體積分數的關系。根據圖中a點數據計算N2的平衡體積分數:___。
(4)依據溫度對合成氨反應的影響,在圖3坐標系中,畫出一定條件下的密閉容器內,從通入原料氣開始,隨溫度不斷升高,NH3物質的量變化的曲線示意圖___。
(5)上述流程圖中,使合成氨放出的熱量得到充分利用的主要步驟是___(填序號),簡述本流程中提高合成氨原料總轉化率的方法:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組利用文獻資料設計方案對氯及其化合物進行探究。
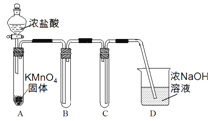
Ⅰ.用高錳酸鉀和濃鹽酸反應制取氯氣
(1)該小組利用右圖裝置及試劑制備并收集適量Cl2,裝置B、C的作用分別是___________、_______________。
(2)制得的氯氣中加入適量水,得到飽和氯水,飽和氯水中含氯元素的微粒有____________(寫出全部微粒)。
(3)飽和氯水與石灰石的反應是制取較濃HC1O溶液的方法之一。在過量的石灰石中加入飽和氯水充分反應,有少量氣泡產生,溶液淺黃綠色褪去,過濾,得到的濾液其漂白性比飽和氯水更強。
①濾液漂白性增強的原因是________________(用化學平衡移動原理解釋)。
②飽和氯水與石灰石反應生成HC1O的方程式是___________________。
Ⅱ. ClO3—、Cl—和H+反應的探究
(4)KClO3、KCl與硫酸可以反應。該小組設計了系列實驗研究反應條件對反應的影響,實驗記錄如下(實驗在室溫下進行):
燒杯編號 | 1 | 2 | 3 | 4 |
氯酸鉀飽和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化鉀固體 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | (____)mL | 8mL |
現象 | 無現象 | 溶液呈淺黃色 | 溶液呈黃綠色,生成淺黃綠色氣體 | 溶液呈黃綠色, |
①該系列實驗的目的_______________________。
②燒杯3取用硫酸的體積應為______________mL。
(5)該小組同學查資料得知:將氯酸鉀固體和濃鹽酸混合也能生成氯氣,同時有大量ClO2生成;ClO2沸點為10℃,熔點為-59℃,液體為紅色;Cl2沸點為-34℃,液態為黃綠色。設計最簡單的實驗驗證Cl2中含有ClO2______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.某學校化學興趣小組欲用下列裝置制取純凈的氯氣及氯化物,并探究其性質。

回答下列問題:
(1)鏈接好實驗裝置后的第一步實驗操作是__________________;儀器x的名稱是_____________;裝置B中的試劑是_____________________。
(2)查閱數據知:濃鹽酸可與K2Cr2O7固體發生反應生成氯氣(Cr2O72-變為Cr3+),寫出上述反應的化學方程式:_________________________________;該反應中還原劑是_________________。
Ⅱ.甲醇(CH3OH)是一種無色有刺激性氣味的液體,在生活中有重要用途,同時也是一種重要的化工原料。
(3)甲醇燃料電池是目前開發最成功的燃料電池之一,這種燃料電池由甲醇、空氣、KOH溶液(電解質溶液)構成,則下列說法正確的是_________________。
(已知甲醇在空氣中燃燒生成CO2和H2O)
A.電池放電時通入空氣的電極為負極
B.電池放電時負極的電極反應式為![]()
C.電池放電時,電解質溶液的堿性逐漸減弱
D.電池放電時每消耗6.4gCH3OH轉移1.2 mol 電子
(4)寫出甲醇燃料電池在酸性條件下負極的電極反應式:________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Mg-H2O2電池可用于驅動無人駕駛的潛航器。該電池以海水為電解質溶液,示意圖如下。該電池工作時,下列說法正確的是( )

A. Mg 電極是該電池的正極
B. H2O2在石墨電極上發生氧化反應
C. 石墨電極附近溶液的pH 增大
D. 溶液中Cl-向正極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了檢驗淀粉的水解情況,某同學設計了以下個實驗方案,并根據實驗現象,得出了相應的結論。
方案價甲:淀粉溶液![]() 水解液
水解液![]() 溶液變為藍色
溶液變為藍色
結論:淀粉未水解
方案乙:淀粉溶液![]() 水解液
水解液![]() 無磚紅色沉淀生成
無磚紅色沉淀生成
結論:淀粉未水解
方案丙:淀粉溶液![]() 水解液
水解液![]() 中和液
中和液![]() 有銀鏡現象
有銀鏡現象
結論:淀粉已經水解完全
根據上述操作及現象首先回答結論是否正確,然后簡要說明理由。如果三個方案均不合理,請另設計一個方案來證明淀粉已經水解完全。
(1)方案甲:________________________________________________。
(2)方案乙:________________________________________________。
(3)方案丙:________________________________________________。
(4)你的方案:________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】COCl2(g)![]() CO(g) + Cl2(g) ΔH > 0,當反應達到平衡時,改變一種反應條件,下列示意圖正確的是 ( )
CO(g) + Cl2(g) ΔH > 0,當反應達到平衡時,改變一種反應條件,下列示意圖正確的是 ( )

① ② ③ ④
A. ①表示隨溫度升高,平衡常數的變化
B. ②表示加入催化劑,反應速率隨時間的變化
C. ③表示恒壓條件下,反應物的轉化率隨充入惰性氣體體積的變化
D. ④表示CO的體積分數隨充入Cl2量的變化
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com