
【題目】下列溶液中,Cl-的物質的量濃度最大的是( )
A.300 mL0.1 mol/L NaCl溶液B.10 mL0.2 mol/LAlCl3溶液
C.標況下4.48LHCl氣體配成的1 L溶液D.100 mL0.1 mol/LFeCl3溶液
 新活力總動員暑系列答案
新活力總動員暑系列答案 龍人圖書快樂假期暑假作業鄭州大學出版社系列答案
龍人圖書快樂假期暑假作業鄭州大學出版社系列答案科目:高中化學 來源: 題型:
【題目】某學生探究0.25 mol·L-1 Al2(SO4)3溶液與0.5 mol·L-1 Na2CO3溶液的反應,實驗如下。下列分析錯誤的是
實驗1 |
|
實驗2 |
|
A. 實驗1中,白色沉淀a是Al(OH)3
B. 實驗2中,白色沉淀b中含有CO![]()
C. 檢驗白色沉淀a、b是否洗滌干凈,不可使用相同的檢驗試劑
D. 實驗1、2中,白色沉淀成分不同可能與混合后溶液的pH有關
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】稀土是一種重要的戰略資源。氟碳鈰礦主要化學成分為CeFCO3,它是提取鈰等稀土元素的重要礦物原料。氟碳鈰礦的冶煉工藝流程如下:
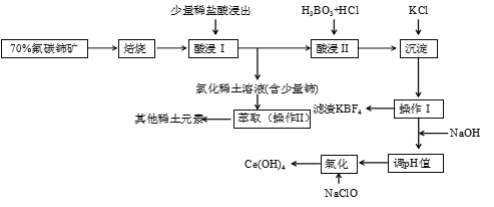
已知:i.鈰的常見化合價為+3、+4。焙燒后鈰元素轉化成CeO2和CeF4。四價鈰不易進入溶液,而三價稀土元素易進入溶液。
ii.酸浸II中發生反應:
9CeO2 + 3CeF4 + 45HCl + 3H3BO3 = Ce(BF4)3↓+ 11CeCl3 + 6Cl2↑+ 27H2O
請回答下列問題:
(1)①焙燒氟碳鈰礦的目的是______________________________________。
②焙燒后產生的CeO2是汽車尾氣凈化催化劑的關鍵成分,它能在還原氣氛中供氧,在氧化氣氛中耗氧。在尾氣消除過程中發生著CeO2![]() CeO2(1-x)+xO2↑的循環。寫出CeO2消除CO尾氣的化學方程式:___________________________________________。
CeO2(1-x)+xO2↑的循環。寫出CeO2消除CO尾氣的化學方程式:___________________________________________。
(2)在酸浸I中用鹽酸浸出時,有少量鈰進入濾液,且產生黃綠色氣體。少量鈰進入稀土溶液發生反應的離子方程式是_________________________________________________________
(3)向Ce(BF4)3中加入KCl溶液的目的是_____________________________________。
(4)操作I的名稱為__________,在實驗室中進行操作II時所需要的硅酸鹽儀器有______。
(5)“操作I”后,向溶液中加入NaOH溶液來調節溶液的pH,以獲得Ce(OH)3沉淀,常溫下加入NaOH調節溶液的pH應大于_______即可認為Ce3 +已完全沉淀。
(已知:Ksp[Ce(OH)3]=1.0×10-20 )
(6)取上述流程中得到的Ce(OH)4產品5.000 g,加酸溶解后,向其中加入含0.03300 molFeSO4的FeSO4溶液使Ce4 +全部被還原成Ce3 +,再用0.1000 mol·L-1的酸性KMnO4標準溶液滴定至終點時,消耗20.00 mL標準溶液。則該產品中Ce(OH)4的質量分數為________(已知氧化性:Ce4+>KMnO4; Ce(OH)4的相對分子質量為208)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可以證明可逆反應N2+3H2![]() 2NH3已達到平衡狀態的是
2NH3已達到平衡狀態的是
①一個N≡N鍵斷裂的同時,有3個H﹣H鍵斷裂
②一個N≡N鍵斷裂的同時,有6個N﹣H鍵斷裂
③其他條件不變時,混合氣體平均相對分子質量不再改變
④恒溫恒容時,體系壓強不再改變
⑤NH3、N2、H2的體積分數都不再改變
⑥恒溫恒容時,混合氣體密度保持不變
⑦正反應速率v(H2)=0.6molL﹣1min﹣1,逆反應速率v(NH3)=0.4molL﹣1min﹣1
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能用溶解、過濾、結晶的方法來分離的一組物質是 ( )
A. NaCl 和 淀粉 B. BaSO4 和 CaCO3
C. CuO 和 KCl D. Mg(NO3)2 和 I2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】同位素在化學研究方面有重要用途,化學家利用18O成功研究了某化學反應的歷程。下列關于18O與16O的敘述錯誤的是
A.18O 與16O 的物理性質相同
B.18O 與 16O的化學性質相同
C.18O 與 16O的質子數相同
D.18O與 16O的中子數不同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校化學興趣小組為研究氯氣的性質,設計如圖所示裝置進行實驗,裝置Ⅲ中夾持裝置已略去,其中a為干燥的品紅試紙,b為濕潤的品紅試紙.
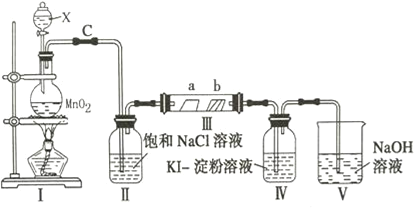
(1)寫出儀器X的名稱__________________.
(2)加入藥品前,檢查Ⅰ中氣體發生裝置氣密性的操作是:用止水夾夾住C處_________________
(3)寫出裝置Ⅰ中發生反應的離子方程式_______________________________________
(4)實驗過程中,裝置Ⅳ中的實驗現象為______________________________________
(5)實驗過程中,該組同學在裝置Ⅲ中觀察到b的紅色褪去,但是并未觀察到“a無明顯變化”這一預期現象的原因是______________________________________,為達到預期現象,應如何改進裝置___.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法正確的是 ( )
A.5.6g Fe與2.24L Cl2充分反應轉移電子數為0.2NA
B.0.1 mol KI與0.1 mol FeCl3在溶液中反應轉移的電子數為0.1 NA
C.2 g H218O與D216O的混合物中所含中子、電子數目均為NA
D.16 g S8 (分子結構:![]() )中的共價鍵數目為NA
)中的共價鍵數目為NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com