

分析 (1)2CuFeS2+O2=Cu2S+2FeS+SO2中,生成1molCu2S轉移6mol電子,由Cu2S+O2═2Cu+SO2可知消耗1molCu2S生成2molCu;
(2)由工藝流程可知,A中的反應為2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,B中的反應為4Fe2++O2+4H+=4Fe3++2H2O,C中鐵離子循環利用,結合氧化還原反應中氧化劑的氧化性大于氧化產物的氧化物分析;
(3)①由電荷守恒計算x;
②由電子守恒計算R中N元素的化合價,從而判斷R;
③由反應可知,參加反應的Cu和消耗的HNO3物質的量之比為3:x.
解答 解:(1)反應2CuFeS2+O2=Cu2S+2FeS+SO2中,化合價變化情況為:Cu元素由+2價降低為+1價,S元素由-2價升高到+4價,氧氣中O元素由0降低為-2價,則每生成1molCu2S轉移電子6mol;由Cu2S+O2═2Cu+SO2可知消耗1molCu2S生成2molCu,所以當第二個反應生成1molCu時,第一個反應轉移電子3mol,故答案為:3;
(2)由工藝流程可知,A中的反應為2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,B中的反應為4Fe2++O2+4H+=4Fe3++2H2O,C中鐵離子循環利用,
①由上述分析可知溶液A中的反應為2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故答案為:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
②A中發生2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,溶液B中發生4Fe2++O2+4H+=4Fe3++2H2O,由氧化劑的氧化性大于氧化產物的氧化性可知氧化性為O2>Fe3+>SO42-,
故答案為:O2>Fe3+>SO42-;
(3)①由電荷守恒可得:(-2)+x=2×3,則x=8,故答案為:8;
②設R中氮元素的化合價為a,由得失電子守恒可得:2×(5-a)=2×3,解得a=+2,則R為NO,故答案為:NO;
③由①和②可知該反應的離子方程式為3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,參加反應的Cu和消耗HNO3的物質的量之比為3:8,故答案為:3:8.
點評 本題以銅及其化合物為載體考查氧化還原反應的計算,為高頻考點,把握發生的反應及反應中元素的化合價變化為解答的關鍵,側重分析、計算能力的綜合考查,題目難度不大.


 精英口算卡系列答案
精英口算卡系列答案科目:高中化學 來源: 題型:選擇題
| A. | F-的結構示意圖: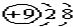 | |
| B. | 乙烷和丙烯互為同系物 | |
| C. | NaCl的電子式:Na${\;}_{×}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$ | |
| D. | H2、D2、T2屬于同位素,化學性質幾乎完全相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 稀鹽酸,Na2CO3溶液 | B. | 稀H2SO4溶液,NaAlO2溶液 | ||
| C. | Cl2,NaBr溶液 | D. | CO2,澄清石灰水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 能使品紅褪色 | |
| B. | 能使濕潤的藍色石蕊試紙變紅 | |
| C. | 通入足量的NaOH溶液中,再滴入BaCl2溶液有白色沉淀生成,該沉淀溶于稀鹽酸 | |
| D. | 通入稀溴水中能使溴水褪色,得澄清溶液,再滴加Ba(NO3)2溶液有白色沉淀,該沉淀不溶于硝酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳的燃燒熱大于110.5 kJ•mol-1 | |
| B. | 濃硫酸與稀NaOH溶液反應生成1 mol水,放出57.3 kJ熱量 | |
| C. | 氫氣的燃燒熱為241.8 kJ•mol-1 | |
| D. | 2H2(g)+O2(g)=2H2O(l) 的反應熱為△H=+571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S2- | B. | HCO3- | C. | Al3+ | D. | Fe2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com