
(1)工業合成氨的反應:N2+3H2= 2NH3是一個放熱反應。已知該反應生成2mol NH3放出92kj熱量。如果1 mol N2和3 mol H2混合,使其充分反應,放出的熱量_____(“大于”、“小于”、“等于”)上述數值,其原因是___________。
(2)將4molA氣體和2mol B氣體在2L的密閉容器中混合并在一定條件下發生如下反應 2A(g)+ B(g) 2C(g)過2s測得C的濃度為0.6mol/L,則用物質A表示的平均反應速率為_____, 2s時物質A的轉化率為_____,2s時物質B的濃度為_____。
2C(g)過2s測得C的濃度為0.6mol/L,則用物質A表示的平均反應速率為_____, 2s時物質A的轉化率為_____,2s時物質B的濃度為_____。
科目:高中化學 來源:2015-2016學年山東省高二下期中化學試卷(解析版) 題型:實驗題
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一種化工原料,常溫下為無色液體,不溶于水,沸點為142.4℃,密度比水小.某實驗小組利用如下裝置合成正丁醚(其它裝置均略去),發生的主要反應為:2C3CH2CH2CH2OH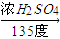 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
實驗過程如下:在容積為100mL的三頸燒瓶中將5mL濃硫酸、14.8g正丁醇和幾粒沸石混合均勻,再加熱回流一段時間,收集到粗產品,精制得到正丁醚。回答下列問題:
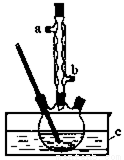
(1)合成粗產品時,液體試劑加入順序是_______。
(2)實驗中冷凝水應從_______口出去(填“a”或“b”).
(3)為保證反應溫度恒定在135℃,裝置C中所盛液體必須具有的物理性質為_______。
(4)加熱時間過長或溫度過高,反應混合液會變黑,寫出可能發生的有機副反應的化學方程式:_______,用NaOH溶液吸收有毒尾氣的離子方程式_______。
(5)得到的正丁醚粗產品依次用8mL 50%的硫酸、10mL水萃取洗滌。該步驟中需要的屬于硅酸鹽材質的實驗儀器是燒杯、玻璃棒、_______,將分離出的有機層用無水氯化鈣干燥,過濾后再進行_______(填操作名稱)精制得到正丁醚。
(6)本實驗最終得到6.50g正丁醚,則正丁醚的產率是_______。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年天津市高一下期中化學試卷(解析版) 題型:填空題
(1)判斷下列說法,正確的是 。
①某有機物完全燃燒后生成二氧化碳和水,說明該有機物中必定含有C、H、O3種元素
②煤的干餾是化學變化,石油分餾也是化學變化,煤的氣化是物理變化
③淀粉、纖維素、油脂、蛋白質可以作為營養物質被人利用和吸收
④將蔗糖放入試管中,加水和稀硫酸震蕩,水溶加熱5分鐘,取水3ml加入新制的Cu(OH)2,加熱后沒有看到磚紅色物質出現,這是因為加熱時間不夠;
⑤油脂在堿性條件下水解反應成為皂化反應
⑥聚乙烯、聚氯乙烯、聚苯乙烯等高分子化合物都是由加聚反應制得的
⑦海水淡化的主要方法是蒸餾法、電滲析法、離子交換法等。其中蒸餾法歷史最久,技術和工藝成熟且成本低。
(2)碳原子數四到十的烷烴中其一氯化物只有一種的是 (寫結構簡式)
(3)苯環上發生溴化所用的試劑和條件 ,該反應的反應類型為 。
(4)兩氣體a、b分別為0.6mol與0.5mol。在0.4L密閉容器中發生反應2a+b mc+d,經5min后達到平衡,此時c為0.2mol.又知在此反應期間d的平均反應速率為0.1mol·L-1·min-1,求
mc+d,經5min后達到平衡,此時c為0.2mol.又知在此反應期間d的平均反應速率為0.1mol·L-1·min-1,求
①m的值為 ②b的轉化率為 ③a的平均反應速率為 ④寫出計算過程 ;
查看答案和解析>>
科目:高中化學 來源:2015-2016學年天津市高一下期中化學試卷(解析版) 題型:選擇題
下面關于化學反應的限度的敘述中,正確的是
A.化學反應的限度都相同
B.可以通過改變溫度控制化學反應的限度
C.可以通過延長化學反應的時間改變化學反應的限度
D.當一個化學反應在一定條件下達到限度時,反應即停止
查看答案和解析>>
科目:高中化學 來源:2015-2016學年天津市高一下期中化學試卷(解析版) 題型:選擇題
下列反應中屬于加成反應的是
A乙烯使酸性KMnO4溶液褪色
B.將苯滴入溴水中,振蕩后水層接近無色
C.乙烯使溴水褪色
D.甲烷與氯氣混合,黃綠色消失
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山西省高一下期中化學試卷(解析版) 題型:選擇題
有A、B、C、D四種金屬,將A與B用導線連接起來,侵入電解質溶液中,B為正極;.將A、D分別投入等濃度鹽酸中,D比A反應劇烈.將銅浸入B的鹽溶液里,無變化.如把銅浸入C的鹽溶液里,有金屬C析出.據此判斷它們的活動性由強到弱的順序是( )
A.D>C> A>B B .D>A>B>C C.D>B>A>C D.B>A>D>C
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山西省高一下期中化學試卷(解析版) 題型:選擇題
下列有關化學反應速率的說法正確的是
A.用鐵片和稀硫酸反應制取氫氣時,改用98%的濃硫酸可以加快產生氫氣的速率
B.100mL2mol/L的鹽酸跟鋅片反應,加入適量的氯化鈉溶液,反應速率不變
C.SO2的催化氧化時一個放熱的反應,所以升高溫度,反應速率減慢
D.汽車尾氣中的NO和CO可以緩慢生成N2和CO2,減小壓強,反應速率減慢
查看答案和解析>>
科目:高中化學 來源:2015-2016學年寧夏育才中學高一下期中化學試卷(解析版) 題型:填空題
如圖所示,把試管放入盛有25℃飽和石灰水的燒杯中,試管開始放入幾小塊鎂片,再用滴管滴入5mL鹽酸于試管中。試回答下列問題:
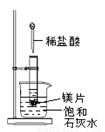
(1)實驗中觀察到的現象是____________________;
(2)產生上述現象的原因是____________________;
(3)寫出有關的離子方程式:________________ __。
(4)由實驗推知,反應中生成MgCl2和H2形成化學鍵時
所釋放的總能量____(填“大于”“小于”或“等于”)消耗鎂片和鹽酸時斷裂化學鍵所吸收的總能量。
查看答案和解析>>
科目:高中化學 來源:2016屆陜西省高三第六次適應性考試理綜化學試卷(解析版) 題型:填空題
二甲醚(CH3OCH3)是一種應用前景廣闊的清潔燃料,以CO和H2為原料生產二甲醚主要發生以下三個反應:
編號 | 熱化學方程式 | 化學平衡常數 |
① | CO(g)+2H2(g) | K1 |
② | 2CH3OH(g) | K2 |
③ | CO(g)+H2O(g) | K3 |
回答下列問題:
(1)已知反應①中的相關的化學鍵鍵能數據如下:
化學鍵 | H-H |
| C=O | H-O | C-H |
E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
由上述數據計算ΔH1= 。
(2)該工藝的總反應為3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) ΔH
CH3OCH3(g)+CO2(g) ΔH
該反應ΔH= ,化學平衡常數K= (用含K1、K2、K3的代數式表示)。
(3)下列措施中,能提高CH3OCH3產率的有________。
A.分離出二甲醚 B.升高溫度
C.改用高效催化劑 D.增大壓強
(4)工藝中反應①和反應②分別在不同的反應器中進行,無反應③發生。該工藝中反應③的發生提高了CH3OCH3的產率,原因是_______________________________。
(5)以=2 通入1 L的反應器中,一定條件下發生反應:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH,其CO的平衡轉化率隨溫度、壓強變化關系如圖所示。下列說法正確的是____。
CH3OCH3(g)+H2O(g) ΔH,其CO的平衡轉化率隨溫度、壓強變化關系如圖所示。下列說法正確的是____。
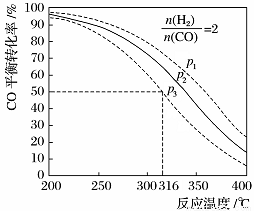
A.該反應的ΔH>0
B.若在p2和316℃時反應達到平衡,則CO的轉化率小于50%
C.若在p3和316℃時反應達到平衡,H2的轉化率等于50%
D.若在p3和316℃時,起始時=3,則達平衡時CO的轉化率大于50%
E.若在p1和200℃時,反應達平衡后保持溫度和壓強不變,再充入2 mol H2和1 mol CO,則平衡時二甲醚的體積分數增大
(6)某溫度下,將8.0mol H2和4.0mol CO充入容積為2 L的密閉容器中,發生反應:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g),反應達平衡后測得二甲醚的體積分數為25%,則該溫度下反應的平衡常數K= 。
CH3OCH3(g)+H2O(g),反應達平衡后測得二甲醚的體積分數為25%,則該溫度下反應的平衡常數K= 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com