
| X | Y | Z | M | R | Q | |
| 原子半徑/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合價 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其他 | 常溫下該單質為黃色固體 | 無機非金屬材料的主角 | 焰色反應呈黃色 | 其氧化物可做耐火材料 |
分析 X、Y、Z、M、R、Q是短周期主族元素,常溫下X單質為黃色固體,則X為S元素;Y的化合價主要為-4,+4,是無機非金屬材料的主角,則Y為Si元素;Z焰色反應呈黃色,則Z為Na元素;R的主要化合價為-1,+7,則R為Cl元素;Q主要化合價為+3價,原子半徑Na>Q>Cl,則Q為Al元素;M的主要化合價為-2價,為第ⅥA族元素,原子半徑M<Cl,則M為O元素,據此解答.
解答 解:X、Y、Z、M、R、Q是短周期主族元素,常溫下X單質為黃色固體,則X為S元素;Y的化合價主要為-4,+4,是無機非金屬材料的主角,則Y為Si元素;Z焰色反應呈黃色,則Z為Na元素;R的主要化合價為-1,+7,則R為Cl元素;Q主要化合價為+3價,原子半徑Na>Q>Cl,則Q為Al元素;M的主要化合價為-2價,為第ⅥA族元素,原子半徑M<Cl,則M為O元素.
(1)Q為Al元素,在元素周期表中的位置是:第三周期ⅢA族,故答案為:第三周期ⅢA族;
(2)Si與Cl同主族,隨原子序數增大非金屬性增強,故Cl元素非金屬性更強,
a.位置狀態屬于物理性質,不能比較非金屬性強弱,故a錯誤;
b.非金屬性越強,氫化物越穩定性,故b正確;
c.Y與R形成的化的中Y呈正價,說明R(Cl)對鍵合電子吸引力更強,硫元素非金屬性強,故c正確,
故答案為:Cl;bc;
(3)同周期隨原子序數增大,原子半徑減小,電子層越多原子半徑越大,Si的原子半徑的最小范圍是:0.099nm<r(Si)<0.143nm,
故答案為:0.099nm<r(Si)<0.143nm;
(4)甲、乙是上述某些元素的最高價氧化物對應的水化物,且甲+乙→丙+水,若丙的水溶液呈堿性,應是氫氧化鋁與氫氧化鈉反應生成偏鋁酸鈉與水,或硅酸與氫氧化鈉反應生成硅酸鈉與水,則丙的化學式是NaAlO2或Na2SiO3,
故答案為:NaAlO2或Na2SiO3;
(5)單質硫的燃燒熱為296kJ•mol-1,則熱化學方程式為:S(s)+O2=SO2(g)△H=-296kJ/mol,
1mo1SO2(g)被氧化為1mo1SO3(g)的△H=-99kJ/mo1,則熱化學方程式為:2SO2(g)+O2=2SO3(g)△H=-198kJ/mol,
根據蓋斯定律,可知S(s)生成3mo1SO3(g)的△H=(-296kJ/mol)×3+$\frac{3}{2}$×(-198kJ/mo1)=-1185kJ/mol,
故答案為:2SO2(g)+O2=2SO3(g)△H=-198kJ/mol;-1185kJ/mol.
點評 本題考查結構性質位置關系應用、無機物推斷、反應熱有關計算等,推斷元素是解題關鍵,是對學生綜合能力的考查,難度中等.


 小學教材全測系列答案
小學教材全測系列答案 小學數學口算題卡脫口而出系列答案
小學數學口算題卡脫口而出系列答案科目:高中化學 來源: 題型:解答題
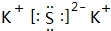 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | M:MaOH X:CO2 | B. | M:HNO3 X:Fe | C. | M:S X:O2 | D. | M:Al X:NaOH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:W>Z>Y>X>M | |
| B. | 在上述五種元素形成的單質中,X元素可形成幾種同素異形體 | |
| C. | XZ2、X2M2、W2Z2均為直線型的共價化合物 | |
| D. | 由X、Y、Z、M四種元素形成的化合物一定沒有離子鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 鋁、鐵、銅是人類生活和生產中具有廣泛應用的三種金屬單質,高中段的學習常把它們及化合物歸結為重要的三角關系(圖1所示):請回答下列問題:
鋁、鐵、銅是人類生活和生產中具有廣泛應用的三種金屬單質,高中段的學習常把它們及化合物歸結為重要的三角關系(圖1所示):請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| R | T | |
| X | Y | Z |
| A. | R位于元素周期表中第二周期第ⅣA族 | |
| B. | 原子半徑:X<R<T | |
| C. | 最簡單氣態氫化物穩定性:T>R>Y | |
| D. | 最高價氧化物的水化物酸性:T>R>Y |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 分類標準 | 金屬單質 | 酸性氧化物 | 堿性氧化物 | 溶液 | 膠體 | 電解質 |
| 屬于該類的物質 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| AgCl | Agl | Ag2S | |
| KSP(單位省略) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
| A. | 沉淀轉化的實質就是沉淀溶解平衡的移動 | |
| B. | 溶解度小的沉淀可以轉化為溶解度更小的沉淀 | |
| C. | AgCl固體在等物質的量濃度的NaCl、CaCl2 溶液中的溶解度相同 | |
| D. | 25℃時,在飽和AgCl、Agl、Ag2S溶液中,所含Ag+的濃度相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
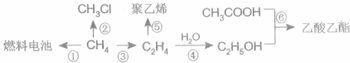
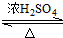 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com