
煤化工中常需研究不同溫度下平衡常數、投料比及熱值等問題。已知:
CO(g)+H2O(g) H2(g)+CO2(g)平衡常數隨溫度的變化如下表:
H2(g)+CO2(g)平衡常數隨溫度的變化如下表:
| 溫度/℃ | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
 H2(g)+CO2(g),當反應達平衡時,CO的體積分數為X,若維持容器的體積和溫度不變,起始物質按下列四種配比充入該容器中,達到平衡時CO的體積分數不等于X的有
H2(g)+CO2(g),當反應達平衡時,CO的體積分數為X,若維持容器的體積和溫度不變,起始物質按下列四種配比充入該容器中,達到平衡時CO的體積分數不等于X的有 (10分)(每空2分)(1)放熱(2)ACD(3)BC(4)x(5)1 1073
解析試題分析:(1)由表可知,溫度越高,平衡常數越小,反應進行程度越小,平衡向逆反應移動,升高溫度平衡向吸熱方向移動,故正反應為放熱反應;(2)A.加入催化劑只改變反應速率不改變化學平衡,錯誤;B.增大CO的物質的量以提高體系的壓強,CO(g)+H2O(g)?H2(g)+CO2(g)反應是氣體物質的量不變的反應,增大一氧化碳物質的量平衡正向進行,容器內氣體物質的量增大,壓強增大,正確;C.反應是放熱反應,降溫,速率減小平衡正向進行,錯誤;D.減小氫氣濃度,平衡正向進行,但速率減小,錯誤.(3)向某密閉容器中充入2molCO和4molH2O(g),CO(g)+H2O(g)?H2(g)+CO2(g),當反應達平衡時,CO的體積分數為X;A.采用極限分析法,1molCO(g)+4molH2O+2molCO2(g)+2molH2(g),假如反應完全轉化為CO和H2O物質的量為:3mol:6mol=1:2,反應前后氣體體積不變,平衡相同,CO的體積分數為x,不符合;B.采用極限分析法,2molCO(g)+2molH2O+2molCO2(g)+2molH2(g),假如反應完全轉化為CO和H2O物質的量為:3mol:3mol=1:1,反應前后氣體體積不變,平衡正向進行,CO的體積分數大于x,符合;C.采用極限分析法,1molCO(g)+3molH2O+0.8molCO2(g)+0.8molH2(g),假如反應完全轉化為CO和H2O物質的量為:1.8mol:3.8mol=9:19,反應前后氣體體積不變,平衡正向進行,CO的體積分數小于x,符合;D.采用極限分析法,1molCO(g)+3molH2O+1molCO2(g)+1molH2(g),假如反應完全轉化為CO和H2O物質的量為2mol:4mol=1:2,當反應達到平衡時,CO的體積分數為x.不符合.
(4)因800℃時反應平衡常數為1.
CO(g)+ H2O(g)? H2(g)+ CO2(g),
起始:5(1-x) 5x 0 0
轉化:5(1-x)y 5(1-x)y 5(1-x)y 5(1-x)y
平衡:5(1-x)(1-y)5(x-y+xy) 5(1-x)y 5(1-x)y
所以平衡常數k=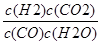 =
=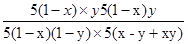 =1,解得y=x;(5)由方程式CO(g)+H2O(g)?H2(g)+CO2(g)可知,有1molCO反應則生成1molH2,開始通入10molCO,所以平衡時,CO、H2的物質的量共為10mol.則平均燃燒熱為=284.5kJ/mol,利用平均值法計算CO、H2的物質的量之比,設CO、H2物質的量為x、y;x+y=10 283x+286y=2845 計算得到x=y=5mol;
=1,解得y=x;(5)由方程式CO(g)+H2O(g)?H2(g)+CO2(g)可知,有1molCO反應則生成1molH2,開始通入10molCO,所以平衡時,CO、H2的物質的量共為10mol.則平均燃燒熱為=284.5kJ/mol,利用平均值法計算CO、H2的物質的量之比,設CO、H2物質的量為x、y;x+y=10 283x+286y=2845 計算得到x=y=5mol;
利用三段式法求出平衡時各組分的物質的量,
CO(g)+H2O(g)?H2(g)+CO2(g),
起始:10mol 10mol 0 0
轉化:5mol 5 mol 5mol 5mol
平衡:5mol 5mol 5mol 5mol
所以常數平衡常數為K=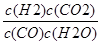 =1;圖表分析可知溫度為800°C,T=273+800=1073K.
=1;圖表分析可知溫度為800°C,T=273+800=1073K.
考點:化學平衡常數的含義;化學平衡的影響因素;等效平衡;化學平衡的計算


科目:高中化學 來源: 題型:填空題
如圖所示,B中活塞可以自由滑動。A、B中均有1mol X、1mol Y,起始時,V(A)=V(B)=a L。關閉K,相同溫度下,兩容器中同時發生反應:2X(g)+2Y(g) Z(g)+2W(g) ΔH<0,達到平衡(Ⅰ)時,V(B)=0.8a L。
Z(g)+2W(g) ΔH<0,達到平衡(Ⅰ)時,V(B)=0.8a L。
(1)達到平衡所需的時間:A B。(填“>”、“<”、或“=”,下同)
(2)W的百分含量:A B。
(3)B中X的轉化率為 。
(4)打開K,重新達平衡(Ⅱ)時,B的體積為 L(用含a的式子表示,連通管體積忽略不計)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
用純凈的碳酸鈣跟稀鹽酸反應制取二氧化碳氣體,請回答:
(1)實驗過程如右圖所示,分析判斷: 段化學反應速率最快, 段收集的二氧化碳最多。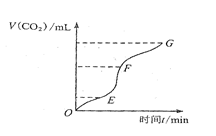
(2)為了減緩上述化學反應的速率,欲向溶液中加入下列物質,你認為可行的是( )
| A.蒸餾水 | B.NaCl固體 | C.NaCl溶液 | D.濃鹽酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知A(g)+B(g)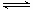 2 C(g)反應的平衡常數和溫度的關系如下:
2 C(g)反應的平衡常數和溫度的關系如下:
| 溫度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常數 | 1.70 | 1.10 | 1.00 | 0.60 | 0.40 |
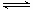 A(g)+B(g)的平衡常數的值為 。
A(g)+B(g)的平衡常數的值為 。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
合成氨技術的創立開辟了人工固氮的重要途徑,其研究來自正確的理論指導,合成氨反應的平衡常數K值和溫度的關系如下:
| 溫 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
 CO(g)+3H2(g) 獲取,已知該反應中,當初始混合氣
CO(g)+3H2(g) 獲取,已知該反應中,當初始混合氣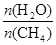 恒定時,溫度、壓強對平衡混合氣CH4含量的影響如下圖所示:
恒定時,溫度、壓強對平衡混合氣CH4含量的影響如下圖所示: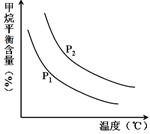
 CO2 (g)+H2(g) 獲取。
CO2 (g)+H2(g) 獲取。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知2A2(g)+B2(g)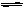 2C(g);△H=" -a" kJ/mol(a >0),在一個有催化劑的固定容積的容器中加入2mol A2和1mol B2,在500℃時充分反應達平衡后C的濃度為w mol/L,放出熱量b kJ。請回答下列問題:
2C(g);△H=" -a" kJ/mol(a >0),在一個有催化劑的固定容積的容器中加入2mol A2和1mol B2,在500℃時充分反應達平衡后C的濃度為w mol/L,放出熱量b kJ。請回答下列問題:
(1)比較a______b(填>、=、<)
(2)此反應的平衡常數表達式為______________________;若將反應溫度升高到700℃,反應的平衡常數將_____________(增大、減小或不變)。
(3)若在原來的容器中,只加入2mol C,500℃時充分反應達平衡后,吸收熱量ckJ,a、b、c之間滿足何種關系__________________(用代數式表示)。
(4)能說明該反應已經達到平衡狀態的是 (填序號,有一個或多個選項符合題意,下同)。
a、v(C)=2v(B2) b、容器內氣體壓強保持不變
c、v逆(A2)=2v正(B2) d、容器內的氣體密度保持不變
(5)為使該反應的反應速率增大,且平衡向正反應方向移動的是_____________。
a、及時分離出C氣體 b、適當升高溫度
c、增大B2的濃度 d、選擇高效的催化劑
(6)若將上述容器改為恒壓容器(反應前體積相同),起始時加入2mol A2和1mol B2, 500℃時充分反應達平衡后,放出熱量dkJ,則d_________b(填>、=、<)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
我國有豐富的天然氣資源。以天然氣為原料合成尿素的主要步驟如下圖所示(圖中某些轉化步驟及生成物未列出):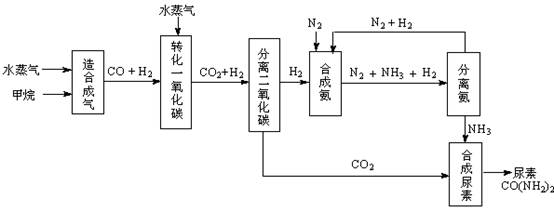
(1)“造合成氣”發生的熱化學方程式是CH4(g)+H2O(g) 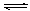 CO(g)+3H2(g);△H>0
CO(g)+3H2(g);△H>0
在恒溫恒容的條件下,欲提高CH4的反應速率和轉化率,下列措施可行的是 。
A、增大壓強 B、升高溫度 C、充入He氣 D、增大水蒸氣濃度
(2)“轉化一氧化碳”發生的方程式是H2O(g) +CO(g) 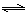 H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下:
H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下:
| 溫度/℃ | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
工業上高純硅可以通過下列反應制取:SiCl4(g)+ 2H2(g)  Si (s)+ 4HCl(g) -236kJ
Si (s)+ 4HCl(g) -236kJ
完成下列填空:
(1)在一定溫度下進行上述反應,若反應容器的容積為2L,H2的平均反應速率為0.1mol/(L·min),3min后達到平衡,此時獲得固體的質量 g。
(2)該反應的平衡常數表達式K= 。可以通過_______使K增大。
(3)一定條件下,在密閉恒容容器中,能表示上述反應一定達到化學平衡狀態的是 。
a.2v逆(SiCl4)=v正(H2)
b.斷開4molSi-Cl鍵的同時,生成4molH-Cl鍵
c.混合氣體密度保持不變
d.c(SiCl4):c(H2):c(HCl)=1:2:4
(4)若反應過程如圖所示,縱坐標表示氫氣、氯化氫的物質的量(mol),橫坐標表示時間(min),若整個反應過程沒有加入或提取各物質,則第1.5分鐘改變的條件是______,第3分鐘改變的條件是__________,各平衡態中氫氣轉化率最小的時間段是_____________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在一定條件下,反應x A+YB zC達到平衡:
zC達到平衡:
(1)若A、B、C均為氣體,則該反應的平衡常數表達式為_______________________;
(2)若A、B、C均為氣體,減壓后平衡向逆反應方向移動,則x、y、z間的關系是___________;
(3)已知C是氣體,且x+y=z,在增大壓強時,若平衡發生移動,則一定向________(填“正”或“逆”)反應方向移動
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com