
【題目】[Cu(NH3)4]SO4H2O是一種殺蟲劑.
(1)Cu元素基態原子的電子排布式為 , 根據元素原子的外圍電子排布特征,可將周期表分成五個區域,其中Cu屬于區.
(2)元素N、O、S的第一電離能由大到小排列的順序為 .
(3)H元素可與O元素形成H2O和H2O2 , H2O2易溶于H2O,其主要原因為 .
(4)H元素與N元素可組成化合物N2H4 , 其中N原子的軌道雜化方式為 .
(5)SO42﹣的空間構型是 , 與SO42﹣互為等電子體的一種分子的化學式為 .
(6)Cu元素與H元素可形成一種紅色晶體,其結構如圖,則該化合物的化學式為 . 
【答案】
(1)[Ar]3d104s1;ds
(2)N>O>S
(3)H2O與H2O2之間形成氫鍵
(4)sp3
(5)正四面體;CCl4或SiCl4或SO2Cl2
(6)CuH
【解析】解:(1)Cu是29號元素,其3d能級上有10個電子、4s能級上有1個電子,根據構造原理書寫Cu原子核外電子排布式[Ar]3d104s1;Cu屬于ds區,所以答案是:[Ar]3d104s1;ds;(2)同一周期元素,元素第一電離能隨著原子序數增大而呈增大趨勢,且第IIA族、第VA族元素第一電離能大于其相鄰元素,同一主族元素,元素第一電離能隨著原子序數增大而減小,所以這三種元素第一電離能大小順序是N>O>S,所以答案是:N>O>S;(3)H2O與H2O2之間能形成氫鍵導致雙氧水易溶于水,所以答案是:H2O與H2O2之間形成氫鍵;(4)肼分子中每個N原子形成3個化學鍵且每個N原子含有1個孤電子對,根據價層電子對互斥理論確定N原子雜化方式為sp3 , 所以答案是:sp3;(5)硫酸根離子價層電子對個數=4+ ![]() =4,根據價層電子對互斥理論確定硫酸根離子空間構型為正四面體;原子個數相同、價電子數相等的微粒互為等電子體,與硫酸根離子互為等電子體的有CCl4或SiCl4或SO2Cl2;所以答案是:正四面體;CCl4或SiCl4或SO2Cl2;(6)該晶胞中Cu原子個數=3+12×
=4,根據價層電子對互斥理論確定硫酸根離子空間構型為正四面體;原子個數相同、價電子數相等的微粒互為等電子體,與硫酸根離子互為等電子體的有CCl4或SiCl4或SO2Cl2;所以答案是:正四面體;CCl4或SiCl4或SO2Cl2;(6)該晶胞中Cu原子個數=3+12× ![]() +2×
+2× ![]() =6,H原子個數=4+6×
=6,H原子個數=4+6× ![]() =6,所以其化學式為CuH,所以答案是:CuH.
=6,所以其化學式為CuH,所以答案是:CuH.


科目:高中化學 來源: 題型:
【題目】按要求完成下列問題
(1)鎂原子的結構示意圖_________________。
(2)氧化鈉的電子式__________________。
(3)Si元素元素周期表中的位置在__________________________。
(4)在原子序數1~20號的元素中,最高價氧化物對應的水化物中堿性最強的是_____(用化學式表示)
(5)元素周期表中最高價氧化物對應水化物酸性最強的是________________(用化學式表示)
(6)短周期元素中,族序數為次外層電子數2倍的元素是_________________。(用元素符號表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】己二酸  是一種工業上具有重要意義的有機二元酸,在化工生產、有機合成工業、醫藥、潤滑劑制造等方面都有重要作用,能夠發生成鹽反應、酯化反應等,并能與二元醇縮聚成高分子聚合物等,己二酸產量居所有二元羧酸中的第二位.實驗室合成己二酸的反應原理和實驗裝置示意圖如下:
是一種工業上具有重要意義的有機二元酸,在化工生產、有機合成工業、醫藥、潤滑劑制造等方面都有重要作用,能夠發生成鹽反應、酯化反應等,并能與二元醇縮聚成高分子聚合物等,己二酸產量居所有二元羧酸中的第二位.實驗室合成己二酸的反應原理和實驗裝置示意圖如下: 
![]()
可能用到的有關數據如下:
物質 | 密度(20℃) | 熔點 | 沸點 | 溶解性 | 相對分子質量 |
環己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃時水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃時,1.44g,25℃時2.3g,易溶于乙醇,不溶于苯 | 146 |
實驗步驟如下;
I、在三口燒瓶中加入16mL 50%的硝酸(密度為1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL環己醇.
Ⅱ、水浴加熱三口燒瓶至50℃左右,移去水浴,緩慢滴加5~6滴環己醇,搖動三口燒瓶,觀察到有紅棕色氣體放出時再慢慢滴加剩下的環己醇,維持反應溫度在60℃~65℃之間.
Ⅲ、當環己醇全部加入后,將混合物用80℃~90℃水浴加熱約10min(注意控制溫度),直至無紅棕色氣體生成為止.
IV、趁熱將反應液倒入燒杯中,放入冰水浴中冷卻,析出晶體后過濾、洗滌得粗產品.V、粗產品經提純后稱重為5.7g.
請回答下列問題:
(1)儀器b的名稱為 .
(2)向三口燒瓶中滴加環己醇時,要控制好環己醇的滴入速率,防止反應過于劇烈導致溫度迅速上升,否則.可能造成較嚴重的后果,試列舉一條可能產生的后果: .
(3)已知用NaOH溶液吸收尾氣時發生的相關反應方程式為:2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O;如果改用純堿溶液吸收尾氣時也能發生類似反應,則相關反應方程式為:、 .
(4)為了除去可能的雜質和減少產品損失,可分別用冰水和洗滌晶體.
(5)粗產品可用法提純(填實驗操作名稱).本實驗所得到的己二酸產率為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、H、I均是由短周期元素組成的中學常見物質,B、D、E、G為單質,F是一種常見的金屬氧化物.A為氯堿工業的產物之一,B元素是地殼中含量最高的金屬元素,C是一種無色無味的液體,D是一種新型能源物質,這些物質的轉化關系如下(反應條件已略去,反應物與生成物都已保留在圖中).
請回答下列問題:
(1)A中所含化學鍵的名稱為;物質I的電子式為 .
(2)寫出②的離子反應方程式 .
(3)若G為實驗室中常用來催化乙醇氧化為乙醛的物質,則F為(寫化學式).
(4)若G為第四周期過渡元素,F與B的混合物常用于鐵路上焊接鐵軌.寫出G與C在一定條件下反應的化學方程式 .
(5)25°C時,pH均為10的A、H兩瓶溶液中,由水電離出來的氫氧根離子濃度之比為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用右圖所示實驗裝置(夾持儀器已略去)探索銅絲與過量濃硫酸反應的產物,下列有關說法不正確的是 ( )
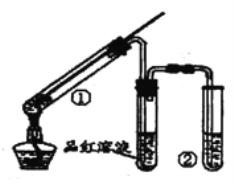
A. 品紅溶液的作用是驗證SO2的漂白性
B. 試管②中盛放的試劑可以是NaOH溶液或Na2SO3溶液
C. 停止反應后,立即向①中加水后溶液呈藍色
D. 該反應中濃硫酸既表現了強氧化性,又表現了酸性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分子式C9H10O2的有機物,其結構中含有苯環且可以與飽和NaHCO3溶液反應放出氣體的同分異構體有(不考慮立體異構)( )
A.12種
B.13種
C.14種
D.15種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各溶液中,微粒的物質的量濃度關系正確的是( )
A.1.0 mol/L Na2CO3溶液:c(OH﹣)=c(HCO ![]() )+c(H+)+2c(H2CO3)
)+c(H+)+2c(H2CO3)
B.1.0 mol/L NH4Cl溶液:c(NH ![]() )=c(Cl﹣)
)=c(Cl﹣)
C.向醋酸鈉溶液中加入適量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
D.1 mol/L CH3COONa溶液,c(CH3COO﹣)=1 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,將一包白色無水硫酸銅粉末投入到150g蒸餾水中,充分攪拌過濾得到一定質量的藍色晶體和84g濾液.又知此溫度下無水硫酸銅的溶解度為40g,則此包無水硫酸銅的質量是( )
A.60 g
B.66 g
C.90 g
D.184 g
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com