
【題目】某同學為探究元素周期表中元素性質的遞變規律,設計了如下系列實驗。
Ⅰ.(1)將鈉、鉀、鎂、鋁各1 mol分別投入到足量的同濃度的鹽酸中,試預測實驗結果:_____與鹽酸反應最劇烈,____與鹽酸反應產生的氣體最多。
(2)向Na2S溶液中通入氯氣出現黃色渾濁,可證明非金屬性:Cl____S(填“>”或“<”),反應的離子方程式為_______。
Ⅱ.利用如圖裝置可驗證同主族元素非金屬性的變化規律。

(3)儀器A的名稱為___________,干燥管D的作用為___________________。
(4)若要證明非金屬性:Cl>I,C中為淀粉—碘化鉀混合溶液,B中裝有KMnO4固體,則A中試劑為___________,觀察到C中溶液____________(填現象),即可證明。從環境保護的觀點考慮,此裝置缺少尾氣處理裝置,可用_________溶液吸收尾氣。
(5)若要證明非金屬性:C>Si,則在A中加鹽酸、B中加CaCO3、C中加Na2SiO3溶液。觀察到C中溶液 ________(填現象),即可證明。但有的同學認為鹽酸具有揮發性,HCl可進入C中干擾實驗,應在兩裝置間添加裝有 _________溶液的洗氣瓶除去。
【答案】鉀 鋁 > Cl2+S2- =S↓+2Cl- 分液漏斗 防止倒吸 濃鹽酸 變藍色 NaOH溶液 產生白色沉淀 NaHCO3
【解析】
I.(1)根據金屬活動性順序表可以判斷鈉、鉀、鎂、鋁的活潑性,活潑性越強,與鹽酸反應越劇烈;根據電子守恒比較生成氫氣體積大小;
(2)單質的氧化性越強,其對應元素的非金屬性越強,根據氧化劑的氧化性大于氧化產物的氧化性得出結論,再根據硫離子被氯氣氧化成硫單質,據此寫出反應的離子方程式;
II.(3)根據儀器的構造與用途作答;尾氣處理裝置中,有緩沖裝置的能防止倒吸;
(4)濃鹽酸和酸性高錳酸鉀溶液發生氧化還原反應生成Cl2,Cl2具有氧化性,能氧化I-生成I2,碘遇淀粉試液變藍色;Cl2和堿反應生成鹽,可以用堿液吸收氯氣;
(5)非金屬的非金屬性越強,其最高價氧化物的水化物酸性越強,再結合強酸制弱酸原理解答;為防止干擾實驗探究,根據除雜原則除去揮發的HCl,據此分析作答。
I.(1)金屬活潑性順序為:鉀>鈉>鎂>鋁,所以相同條件下與鹽酸反應最激烈的是鉀,反應速率最慢的是鋁;生成1mol氫氣需要得到2mol電子,1mol鉀、鈉都失去1mol電子,1mol鎂失去2mol電子,而1mol鋁失去3mol電子,所以生成氫氣最多的是金屬鋁,
故答案為:鉀;鋁;
(2)氯氣氧化性強于硫單質,所以氯氣能夠與硫離子反應生成硫,反應的離子方程式為:Cl2+S2- =S↓+2Cl-,
故答案為:Cl2+S2- =S↓+2Cl-;
II.(3)儀器A的名稱為分液漏斗;尾氣處理裝置中,有緩沖裝置的能防止倒吸,干燥管有緩沖作用,所以能防止倒吸,
故答案為:分液漏斗;防止倒吸;
(4)濃鹽酸和酸性高錳酸鉀溶液發生氧化還原反應生成Cl2,Cl2具有氧化性,能氧化I生成I2,碘遇淀粉試液變藍色,C裝置中看到的現象是溶液變藍色;Cl2和堿反應生成鹽,可以用堿液吸收氯氣,如NaOH溶液,
故答案為:濃鹽酸;溶液變藍色;NaOH;
(5)非金屬的非金屬性越強,其最高價氧化物的水化物酸性越強,強酸能和弱酸鹽反應生成弱酸,所以當C裝置中硅酸鈉溶液中產生白色沉淀說明生成硅酸;為防止HCl可進入C中干擾實驗,可通入NaHCO3的洗氣瓶中除去HCl,
故答案為:產生白色沉淀;NaHCO3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案 目標測試系列答案
目標測試系列答案科目:高中化學 來源: 題型:
【題目】硝酸與金屬反應時,濃度越稀還原產物價態越低。現用一定量的鋁粉與鎂粉組成的混合物與100ml硝酸鉀溶液與硫酸組成的混合溶液充分反應,反應過程中無任何氣體放出,向反應后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液體積與產生的沉淀質量的關系如圖所示。
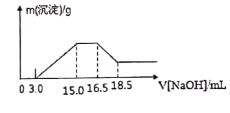
回答下列問題:
(1)寫出鋁與混合溶液反應的離子方程式:_________________
(2)參加反應硝酸根離子物質的量為____________mol
(3)參加反應的鋁與鎂的質量比為_______________
(4)混合液中硫酸的物質的量的濃度為_______________mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國科學技術名詞審定委員會已確定第116號元素Lv的名稱為鉝。關于![]() 的敘述錯誤的是
的敘述錯誤的是
A. 原子序數116 B. 中子數177
C. 核外電子數116 D. 相對原子質量293
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由短周期元素或生活中常見的金屬元素組成的中學常見無機物A、B、C、D、E、X存在如下圖轉化關系(部分生成物和反應條件略去)。下列推斷不正確的是( )
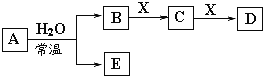
A. 若X是Na2CO3,C為一種溫室氣體,則A一定是氯氣,且D和E不反應
B. 若A是單質,B和D的反應是HCO3- 與OH-反應 ,則E一定能還原Fe2O3
C. 若D為CO,C能和E反應,則A一定為過氧化鈉
D. 若C的溶液遇KSCN顯紅色,則A可能為氮的一種氧化物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在某100mL混合液中,HNO3和H2SO4的物質的量濃度分別是:0.4mol/L、0.1mol/L。向該混合液中加入2.56g銅粉,加熱,待充分反應后,所得溶液中的Cu2+的物質的量濃度(mol/L)是( )
A. 0.15B. 0.225C. 0.35D. 0.45
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、R、M均為短周期元素,X、Y同周期,X、Y兩種元素最高價氧化物對應水化物化學式分別為H2XO4和HYO4。R、M同主族,R與冷水即可反應,M與熱水反應緩慢。下列關系正確的是 ( )。
A. 原子半徑X>Y B. 氫化物穩定性H2X>HY
C. 原子核內質子數R<M D. 溶液堿性R(OH)2<M(OH)2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為除去混在氯化鉀中的少量硫酸鉀和氯化鈣雜質,需進行下列六項操作:
①加水溶解 ②加熱蒸發結晶 ③加入過量氯化鋇溶液 ④加入過量鹽酸 ⑤加入過量碳酸鉀溶液 ⑥過濾。正確的操作順序是
A.①③⑤⑥④②B.①⑤③④⑥②
C.①③④⑥⑤②D.①⑤③⑥④②
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關化學鍵的描述說法正確的是( )
①水分子間以共價鍵相結合成為冰 ②金屬和非金屬元素只能形成離子鍵
③離子鍵是陽離子、陰離子的相互吸引 ④兩個非金屬原子間不可能形成離子鍵
⑤所有物質中一定含有化學鍵
A. ①②⑤ B. 都不正確 C. ④ D. ②③④⑤
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com