一定量的氫氣在氯氣中燃燒,所得混合物用100mL 3.00mol∕L的NaOH溶液恰好完全吸收,測得溶液中含有NaClO的物質的量為0.0500mol.
(1)寫出氫氣在氯氣中燃燒反應的化學方程式和現象:______ 2HCl
【答案】
分析:氫氣在氯氣中燃燒生成HCl,反應的方程式為H
2+Cl
2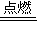
2HCl,氯氣過量,混合氣體與NaOH溶液反應:
2NaOH+Cl
2=NaCl+NaClO+H
2O,NaOH+HCl=NaCl+H
2O,根據反應的方程式計算.
解答:解:(1)氫氣在氯氣中安靜地燃燒,發出蒼白色火焰,生成HCl,反應的方程式為H
2+Cl
2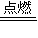
2HCl,故答案為:H
2+Cl
2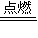
2HCl、安靜燃燒,發出蒼白色火焰;
(2)根據溶液電中性原則可知:n(Na
+)=n(Cl
-)+n(ClO
-),
n(Cl
-)=n(Na
+)-n(ClO
-)=0.1L×3.00mol/L-0.0500mol=0.25mol,故答案為:0.25;
(3)根據Cl原子守恒可知,n(Cl
2)=

×n(NaOH)=0.15mol,
設與NaOH反應的Cl
2物質的量為x,
2NaOH+Cl
2=NaCl+NaClO+H
2O
1mol 1mol
x 0.05mol
x=0.05mol,
設參加反應的氫氣的物質的量為y,
H
2+Cl
2
2HCl
1mol 1mol
y 0.15mol-0.05mol
y=0.1mol,
所用氯氣和參加反應的氫氣的物質的量之比n(Cl
2):n(H
2)=0.15mol:0.1mol=3:2,
故答案為:3:2.
點評:本題考查物質的量應用于化學方程式的計算,題目難度不大,注意從守恒的角度解答.

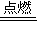 2HCl,氯氣過量,混合氣體與NaOH溶液反應:
2HCl,氯氣過量,混合氣體與NaOH溶液反應: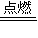 2HCl,故答案為:H2+Cl2
2HCl,故答案為:H2+Cl2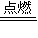 2HCl、安靜燃燒,發出蒼白色火焰;
2HCl、安靜燃燒,發出蒼白色火焰; ×n(NaOH)=0.15mol,
×n(NaOH)=0.15mol, 2HCl
2HCl

 閱讀快車系列答案
閱讀快車系列答案