
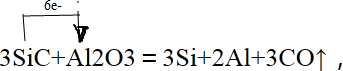 .
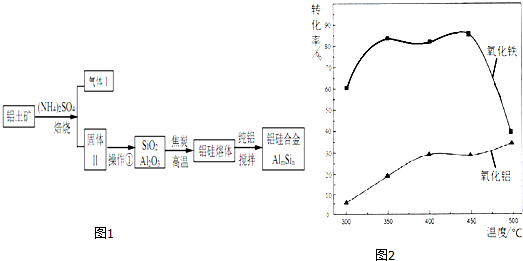
.分析 鋁土礦(含30% SiO2、40.8% Al2O3和少量Fe2O3等)加硫酸銨焙燒,Fe2O3轉化為NH4Fe(SO4)2同時生成氨氣,加水溶解、過濾,濾渣為SiO2和Al2O3,用焦炭在高溫條件下還原SiO2、Al2O3得到硅鋁熔體,在加純鋁攪拌,得到硅鋁合金;
(1)Al、Fe形成原電池,活潑性強的做負極;
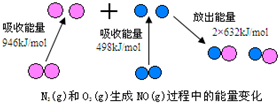
(2)焙燒除鐵反應時 Fe2O3 轉化為NH4Fe(SO4)2,所以 Fe2O3發生反應的方程式:4(NH4)2SO4+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2NH4Fe(SO4)2+3H2O+6NH3↑;焙燒時盡可能是氧化鐵反應,而氧化鋁不反應,由圖可知在300℃時,氧化鐵轉化為硫酸鹽的百分率很高,而氧化鋁轉化為硫酸鹽的百分率最低,所以最適宜焙燒溫度為300℃;(3)溶液中含有鋁離子與氫氧根離子生成偏鋁酸根離子;
(4)在高溫條件下,SiC與Al2O3反應生成Al和CO;
(5)因為Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38,所以向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,首先鐵離子先沉淀,鐵離子全部沉淀后,鋁離子開始沉淀,再滴加氫氧化鈉氫氧化鋁溶解,根據此分析解答.
解答 解:(1)Al、Fe形成原電池,Al活潑性比Fe強的做負極,被腐蝕,所以鋁硅合金材料中若含鐵,容易發生電化學腐蝕;
故答案為:鐵與鋁形成原電池,加快了鋁的腐蝕;
(2)焙燒除鐵反應時 Fe2O3 轉化為NH4Fe(SO4)2,所以 Fe2O3發生反應的方程式:4(NH4)2SO4+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2NH4Fe(SO4)2+3H2O+6NH3↑;焙燒時盡可能是氧化鐵反應,而氧化鋁不反應,由圖可知在300℃時,氧化鐵轉化為硫酸鹽的百分率很高,而氧化鋁轉化為硫酸鹽的百分率最低,所以最適宜焙燒溫度為300℃;
故答案為:4(NH4)2SO4+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2NH4Fe(SO4)2+3H2O+6NH3↑;300℃;
(3)溶液中含有鋁離子與氫氧根離子生成偏鋁酸根離子,其反應的離子方程式為:Al3++4OH-=AlO2-+2H2O;
故答案為:Al3++4OH-=AlO2-+2H2O;
(4)在高溫條件下,SiC與Al2O3反應生成Al和CO,其反應的方程式為: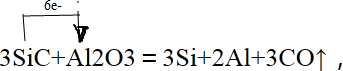 故答案為:
故答案為: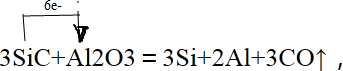 ;
;
(5)當兩種沉淀共存時,由于Ksp[Al(OH)3]=c(Al3+)•c3(OH-),Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-),所以c(Al3+):c(Fe3+)=Ksp[Al(OH)3]:Ksp[Fe(OH)3]=2.5×104,故答案為:2.5×104.
點評 本題考查了物質分離和提純基本操作,注意把握流程中發生的化學反應為解答的關鍵,注重信息與所學知識的結合分析解決問題,側重知識遷移應用能力的考查,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 若G的最高價氧化物水化物為強酸,則J一定是活潑非金屬元素 | |
| B. | HnJOm為強酸,則G是位于VA族以后的活潑非金屬元素 | |
| C. | 若T的最低化合價為-3,則G的最高正化合價為+6 | |
| D. | 若M的最高正化合價為+4,則五種元素不一定都是非金屬元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 混合氣體的壓強不隨時間變化而變化 | |
| B. | 氣體總物質的量不隨時間變化而變化 | |
| C. | 2v正(B)=v逆(D) | |
| D. | 混合氣體的密度保持不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe3O4和Na2O2都屬于堿性氧化物 | B. | KOH和Na2CO3都屬于堿 | ||
| C. | NaHSO4和NaHCO3都屬于酸式鹽 | D. | Na2O和Al2O3都屬于堿性氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉保存在煤油中,是因為煤油不與鈉發生反應,鈉比煤油密度大,煤油可以使鈉隔絕空氣和水蒸氣 | |
| B. | 用潔凈的玻璃管向包有Na2O2的脫脂棉吹氣,脫脂棉燃燒,說明CO2、H2O與Na2O2的反應是放熱反應 | |
| C. | 滴有酚酞的NaHCO3溶液呈淺紅色,微熱后紅色加深,是因為NaHCO3分解生成了Na2CO3. | |
| D. | 鈉長期暴露在空氣中的產物是Na2CO3,原因是鈉與氧氣生成的Na2O與水和二氧化碳反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
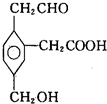 某有機物的結構簡式如圖所示,在一定條件下對于下列反應:
某有機物的結構簡式如圖所示,在一定條件下對于下列反應:| A. | ②③④ | B. | ①③④⑤ | C. | ①③⑤⑥ | D. | ②③④⑤⑥ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com