
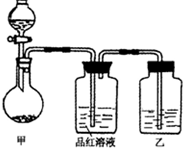
 張明同學在學習“硫酸及其鹽的某些性質與用途“中,進行如下實驗探究.
張明同學在學習“硫酸及其鹽的某些性質與用途“中,進行如下實驗探究.| 實驗操作 | 預期現象和結論 |
| ______ | ______ |

 CuSO4+SO2↑+2H2O(或C+2H2SO4(濃)
CuSO4+SO2↑+2H2O(或C+2H2SO4(濃) CO2↑+2SO2↑+2H2O);
CO2↑+2SO2↑+2H2O); CuSO4+SO2↑+2H2O(或C+2H2SO4(濃)
CuSO4+SO2↑+2H2O(或C+2H2SO4(濃) CO2↑+2SO2↑+2H2O);
CO2↑+2SO2↑+2H2O);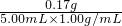 ×100%=3.4%,故答案為:3.4%.
×100%=3.4%,故答案為:3.4%.

科目:高中化學 來源: 題型:閱讀理解
 (2009?三明一模)張明同學在學習“硫酸及其鹽的某些性質與用途“中,進行如下實驗探究.
(2009?三明一模)張明同學在學習“硫酸及其鹽的某些性質與用途“中,進行如下實驗探究.
| ||
| ||
| ||
| ||
| 實驗操作 | 預期現象和結論 |
往一支試管中加入少量固體,加水溶解,再滴加幾滴KSCN溶液 往一支試管中加入少量固體,加水溶解,再滴加幾滴KSCN溶液 |
若溶液變為紅色,說明該固體已變質;若溶液未變紅色,說明該固體沒有變質 若溶液變為紅色,說明該固體已變質;若溶液未變紅色,說明該固體沒有變質 |

查看答案和解析>>
科目:高中化學 來源:三明一模 題型:填空題
| 實驗操作 | 預期現象和結論 |
| ______ | ______ |
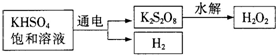
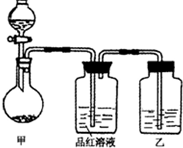
查看答案和解析>>
科目:高中化學 來源:遼寧省模擬題 題型:實驗題
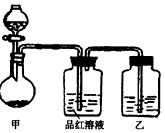

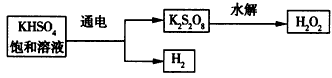
查看答案和解析>>
科目:高中化學 來源:2009年福建省三明市高考化學一模試卷(解析版) 題型:填空題
| 實驗操作 | 預期現象和結論 |
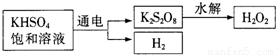
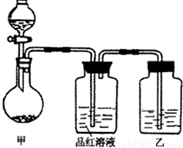
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com