
【題目】下列描述不正確的是( ).
A.在滴有酚酞的 Na2CO3溶液中慢慢滴入BaCl2溶液至過量,溶液的紅色褪去
B.往Na2CO3溶液中加水,![]() 增大
增大
C.pH相同的①NH4Cl、②NH4Al (SO4)2、③NH4HSO4三種溶液中c(NH4+):①>②>③
D.在水電離出的c(H+)=1×10-12 mol/L的溶液中,Al3+一定不可能大量存在
【答案】BD
【解析】
A. 在滴有酚酞的 Na2CO3溶液中慢慢滴入BaCl2溶液至過量,溶液的紅色褪去,碳酸根水解平衡逆向移動,堿性減弱至紅色褪去,故A正確;
B. 往Na2CO3溶液中加水,![]() ,水的離子積常數,電離平衡常數都不變,因此比值不變,故B錯誤。
,水的離子積常數,電離平衡常數都不變,因此比值不變,故B錯誤。
C. pH相同的①NH4Cl、②NH4Al(SO4)2、③NH4HSO4三種溶液,溶液中的氫離子濃度相等,③NH4HSO4是電離顯酸性,即③NH4HSO4濃度最小,③NH4HSO4中c(NH4+)最小,但由于②NH4Al(SO4)2中銨根、鋁離子都水解顯酸性,①NH4Cl中只有銨根水解,兩者水解生成的氫離子一樣多,則②NH4Al(SO4)2中銨根比①NH4Cl中銨根小,因此三種溶液中c(NH4+)大小順序為:①>②>③,故C正確;
D. 在水電離出的c(H+)=1×10-12 mol/L的溶液可能為酸、也可能為堿,是堿則Al3+一定不可能大量存在,是酸則Al3+共存,故D錯誤。
綜上所述,答案為BD。


科目:高中化學 來源: 題型:
【題目】杯環芳烴因其結構類似于酒杯而得名,其鍵線式如圖,下列關于杯環芳烴的說法正確的是( )
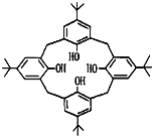
A.屬于芳香烴B.最多與6mol H2發生加成反應
C.分子式為C44H56O4D.分子內所有原子一定在同一平面上
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯化銅晶體(CuCl2·2H2O)中含有FeCl2雜質,為制得純凈的氯化銅晶體,首先將其制成水溶液,再按下圖所示的操作步驟進行提純。
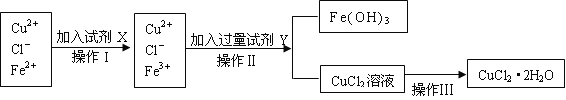
請參照下表給出的數據填空。
氫氧化物開始沉淀時的pH | 氫氧化物沉淀完全時的pH | |
Cu2+ | 4.7 | 6.7 |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.7 |
(1)操作I加入X的目的是_________________。
(2)下列物質都可以作為X,適合本實驗的X物質可以是(填選項)_________ 。
A、KMnO4 B、NaClO C、H2O2 D、Cl2
(3)操作II的Y試劑為____________(填化學式),并調節溶液的pH在______范圍。
(4)實驗室在配制CuCl2溶液時需加入少許_________(填物質名稱),理由是(文字敘述并用有關離子方程式表示)_________________ __________。
(5)若將CuCl2溶液蒸干灼燒,得到的固體是_________________(填化學式);若要得無水CuCl2,請簡述操作方法_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖,將一根較純的鐵棒垂直沒入水中,由于深水處溶氧量較少,一段時間后發現AB段產生較多鐵銹,BC段腐蝕嚴重。下列關于此現象的說法錯誤的是( )
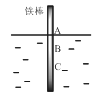
A.該腐蝕過程屬于電化腐蝕
B.鐵棒AB段電極反應為O2 + 2H2O+ 4e-→ 4OH-
C.鐵棒AB段是負極,BC段是正極
D.產生此現象的根本原因是鐵棒所處化學環境的不同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒溫恒容的密閉容器中按照下表甲、乙、丙三種方式分別投料,發生反應:3H2(g)+N2(g) ![]() 2NH3(g),測得甲容器中H2的平衡轉化率為 40%,下列說法正確的是( ).
2NH3(g),測得甲容器中H2的平衡轉化率為 40%,下列說法正確的是( ).
N2(mol) | H2(mol) | NH3(mol) | |
甲 | 1 | 3 | 0 |
乙 | 0.5 | 1.5 | 1 |
丙 | 0 | 0 | 4 |
A.乙容器中反應向逆向進行
B.達到平衡時,甲、乙、丙三容器中NH3體積分數的大小順序:甲=乙>丙
C.乙中的NH3轉化率為40%
D.若丙在恒溫恒壓的密閉容器進行,平衡后往容器中再充入4 mol NH3,重新達到平衡時,體系中NH3體積分數不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燃煤廢氣中的氮氧化物(NOx)、CO2、SO2等氣體,常要采用不同方法處理,以實現節能減排、廢物利用等。
(1)下列為二氧化硫和氮的氧化物轉化的部分環節:
①已知:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6 kJmol-1
2SO3(g) △H=-196.6 kJmol-1
2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0 kJ·mol-1
2NO2(g) △H=-113.0 kJ·mol-1
則SO2氣體與NO2氣體反應生成SO3氣體和NO氣體的熱化學方程式為_________。
②一定條件下,工業上可通過下列反應實現燃煤煙氣中液態硫的回收,其中Y是單質:SO2(g)+2CO(g) ![]() 2X(g)+Y(l)。為了測定在某種催化劑作用下的反應速率,某化學興趣小組在某溫度下、固定容器中用超靈敏氣體傳感器測得不同時間的SO2和CO濃度如下表:
2X(g)+Y(l)。為了測定在某種催化劑作用下的反應速率,某化學興趣小組在某溫度下、固定容器中用超靈敏氣體傳感器測得不同時間的SO2和CO濃度如下表:
時間/s | 0 | 1 | 2 | 3 | 4 |
c(SO2)/mol·L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
c(CO)/mol·L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
X的化學式為___________;當時間為第4 s時,2v(SO2)正____(填“>”“=”或“<”)v(X)逆。
(2)有科學家經過研究發現,在210~290℃、催化劑條件下用H2可將CO2轉化生成甲醇蒸氣和水蒸氣。一定條件下,往2 L恒容密閉容器中充入1 mol CO2和3. 0 mol H2,在不同催化劑作用下,相同時間內CO2的轉化率隨溫度變化如圖所示:

①催化劑效果最佳的是催化劑
②此反應在a點時已達平衡狀態,a點的轉化率比c點高的原因是___________。已知容器內的起始壓強為100 kPa,則圖中c點對應溫度下反應的平衡常數Kp=______(保留兩位有效數字)(Kp為以分壓表示的平衡常數, 分壓=總壓×物質的量分數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A~G是幾種烴分子的球棍模型,據此回答下列問題:
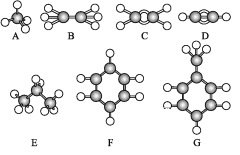
(1)上述七種烴中:
①常溫下含碳量最高的氣態烴是____(填結構簡式)。
②能夠發生加成反應的烴有____種。
③與A互為同系物的是____(填對應字母)。
④一鹵代物種類最多的是____(填對應字母)。
(2)寫出C發生加聚反應的化學方程式:____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水的電離平衡曲線如圖所示,下列說法不正確的是( )
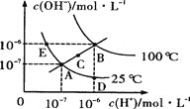
A.圖中五點Kw間的關系B>C>A=D=E
B.若從A點到D點,可采用在水中加入少量酸的方法
C.若處在B點時,將pH=2的硫酸與pH=12的KOH等體積混合后,溶液顯堿性
D.若從A點到C點,可用溫度不變時在水中加入適量NH4Cl固體的方法
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】依據氧化還原反應Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)設計的原電池如下圖所示。
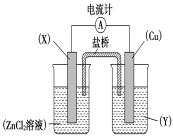
請回答下列問題:
(1)電極X的材料是____________;電解質溶液Y是__________________。
(2)銅電極為電池的________極,發生的電極反應為_______________________ X極上發生的電極反應為______________。
(3)外電路中的電子是從________極流向__________極(填名稱)。
(4)鹽橋中的Cl-向________極移動,如將鹽橋撤掉,電流計的指針將________偏轉。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com