
如下圖,在錐形瓶中按①②③④的順序依次加入試劑后,立刻離開.可以觀察到,大量的藍色泡沫成柱狀沖出錐形瓶,然后有白色泡沫迅速從錐形瓶口逸出,飛舞盤旋,并有大量水蒸氣冒出.用手觸摸錐形瓶,感覺比較燙.
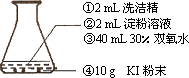
(1)開始沖出的泡沫呈藍色,說明上述反應中生成了單質碘.試寫出KI與H2O2反應生成碘的離子方程式________________________
(2)已知1 mol液態H2O2分解生成液態水和氧氣,放出98.4 kJ的熱量.寫出該反應的熱化學方程式________________.
(3)上述實驗中KI粉末用KMnO4粉末代替,也可產生類似現象.在H2O2分別與這兩種物質反應時,表現的性質有什么不同?
________________
科目:高中化學 來源: 題型:

①配制濃度均為1 mol·L-1的鹽酸和醋酸溶液;
②用_________________量取10.00 mL 1 mol·L-1鹽酸和醋酸溶液分別加入兩個錐形瓶中;
③分別稱取除去表面氧化膜的鎂帶a g,并系于銅絲末端,a的數值至少為_____________;
④在廣口瓶中裝足量的水,按上圖連接好裝置;檢查裝置的氣密性;
⑤將銅絲向下移動,使足量鎂帶浸入酸中(銅絲不與酸接觸),至反應完全,記錄
__________________________________________________________________;
⑥反應結束后待溫度恢復到室溫,若丙中液面高于乙中液面,讀取量筒中水的體積前,應______________________________________________,讀出量筒中水的體積為V mL。
請將上述步驟補充完整并完成下列問題:
(1)用文字表述④檢查裝置氣密性的操作與觀察方法:_______________________________。
(2)本實驗中應選用_________________ (填序號)的量筒。
A.100 mL B.200 mL C.500 mL
(3)若水蒸氣的影響忽略不計,在實驗室條件下,氣體摩爾體積的計算式為:
Vm=_________________。
(4)上述速率不等的原因是___________________________________________________,
銅絲不與酸接觸的原因是___________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

①配制濃度均為1 mol·L-1的鹽酸和醋酸溶液;
②在廣口瓶乙中裝水,按圖示連接好裝置,檢查裝置的氣密性;
③量取10.00 mL 1 mol·L-1的鹽酸和醋酸溶液分別加入兩套裝置的錐形瓶中;
④稱取兩份質量均為a g的鎂條(除去表面氧化膜、表面積相同),并固定于塑料桿末端;
⑤同時將塑料桿向下移動,使鎂條浸入酸中至反應完全;
⑥反應結束后待溫度恢復到室溫,讀出量筒中水的體積為V mL。
請根據上述步驟回答下列問題:
(1)用文字表述步驟②中檢查該裝置氣密性的方法:_____________________。
(2)量取10.00 mL1mol·L-1鹽酸和醋酸溶液分別注入錐形瓶中時,所用的儀器是_________(填下列各項序號字母)。
A.50 mL量筒 B.10 mL量筒
C.25 mL酸式滴定管 D.25 mL堿式滴定管
(3)步驟④中,理論上稱取的鎂條質量不能少于_________ g。
(4)步驟⑤中需記錄的數據是_______;實驗過程中觀察到的主要現象是______________。
(5)步驟⑥中,讀取量筒中水的體積時若俯視讀數,對計算該條件下的氣體摩爾體積影響為_________(填“偏大”“偏小”或“無法確定”)。
(6)為保證實驗順利進行,儀器丙應選用的規格是_________(填序號字母)。
A.100 mL B.200 mL C.500 mL
(7)若水蒸氣的揮發影響忽略不計,在該溫度和壓強下,氣體摩爾體積為______ L·mol-1。
查看答案和解析>>
科目:高中化學 來源:2012-2013學年湖北省黃岡市高三上學期期末考試理綜化學試卷(解析版) 題型:實驗題
某實驗小組為研究草酸的制取和草酸的性質,進行如下實驗。
實驗I:制備草酸
實驗室用硝酸氧化淀粉水解液制備草酸的裝置如圖所示(加熱、攪拌和儀器固定裝置均已略去),實驗過程如下:
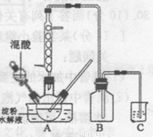
①將一定量的淀粉水解液加人三頸瓶中
②控制反應液溫度在55〜600C條件下,邊攪拌邊緩慢滴加一定量含有適量催化劑的混酸 (65%HNO3與98%H2S04的質量比為2 :1.5)溶液
③反應3h左右,冷卻,抽濾后再重結晶得草酸晶體。
硝酸氧化淀粉水解液過程中可發生下列反應:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2↑+8NO↑+10H2O
3 H2C2O4+2HNO3→6CO2↑+2NO↑+4H2O
(1)檢驗淀粉是否水解完全所需用的試劑為________。
(2)實驗中若混酸滴加過快,將導致草酸產率下降,其原因是________。
實驗II :草酸晶體中結晶水測定
草酸晶體的化學式可表示為H2C2O4 • xH2O,為測定x的值,進行下列實驗:
①稱取6.3g某草酸晶體配成100.0mL的水溶液。
②取25.00mL所配溶液置于錐形瓶中,加入適量稀H2SO4,用濃度為0. 5mol/L的KMnO4溶液滴定,滴定終點時消耗KMnO4 的體積為10.00mL。回答下列問題:
(3)寫出上述反應的離子方程式________________。
(4)計算x=________。
(5)滴定時,常發現反應速率開始很慢,后來逐漸加快,可能的原因是________。
實驗III:草酸不穩定性
查閱資料:草酸晶體(H2C2O4 •xH20),1000C開始失水,100.5℃左右分解產生H2O、CO和CO2。請用下圖中提供的儀器及試劑,設計一個實驗,證明草酸晶體分解得到的混合氣中有H2O、CO和CO2 (加熱裝置和導管等在圖中略去,部分裝置可重復使用)。

回答下列問題:
(6)儀器裝置按連接順序為________。
(7)儀器B中無水硫酸銅的作用________。
(8)能證明混合氣中含有CO的實驗依據是________。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年江蘇省高三百校大聯考一模考試化學試卷 題型:實驗題
(12分,本題包括A、B兩小題,分別對應于“物質結構與性質”和“實驗化學”兩個選修模塊的內容。請選定其中一題,并在相應的答題區域內作答。若兩題都做,則按A題評分)
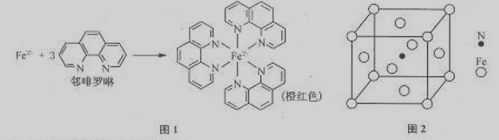
(1)Fe2+在基態時,核外電子排布式為 。
(2)羥胺(NH2OH)中采用sp3雜化的原子有 ,羥胺熔沸點較高,是因為分子間存在較強的 。
(3)Fe2+與鄰啡羅啉形成的配合物(形成過程如圖1)中,配位數為 。
(4)根據價層互訴理論,C1O4—空間構形為 。
(5)鐵能與氮形成一種磁性材料,其晶胞結構如圖2,則該磁性材料的化學式為 。
B.生物柴油是高級脂肪酸甲酯,可由油脂與甲醇通過取代反應(酯交換,生成新酯和新醇)得到,用菜籽油制備生物柴油的步驟如下:
①將三口燒瓶和錐形瓶做干燥處理,先向三口燒瓶中加入20g菜籽油,再稱取40g正已烷(約61mL)。
②稱取甲醇4.6g(約5.8mL)放到錐形瓶中,然后稱取0.2g氫氧化鈉固體并使之溶解,然后加到三口燒瓶中。
③如下圖所示安裝三口燒瓶。
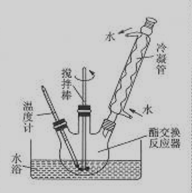
④恒溫水浴加熱,使溫度保持在60—65℃左右,攪拌1.5—2h。
⑤停止加熱后,冷卻,取出三口燒瓶,靜置、分液,上層
為生物紫油,正已烷和甲醇,下層主要為甘油。
⑥用溫水洗滌制得的生物柴油3—4次。
⑦將水洗后的溶液倒入圓底燒瓶中,蒸餾,溫度保持在
120℃左右,直至無液體蒸出后,燒瓶中剩余的液體主要即為
生物柴油。
(1)氫氧化鈉的作用是 。
(2)正已烷的作用是 。
(3)圖中冷凝管的作用是 。
(4)步驟⑤分液,用到的主要的一種玻璃儀器是 (寫名稱)
(5)確定步驟⑥已洗滌干凈的方法是 。
(6)酸價(1g油酯的游離脂肪酸所需氫氧化鉀的毫克數)的測定
a. 稱取均勻試樣Wg注入錐形瓶中,加入石油醚—乙醇混合液25mL,搖動錐形瓶使試樣溶解。
b.滴入3滴酚酞,用0.100 mol/L KOH溶液滴定至出現微紅色且保持30s不消失,消耗KOH溶液VmL。
則該生物柴油的酸價為 (用含W、V的代數式表示)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com