
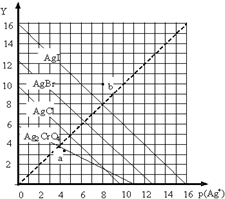
 一定溫度下,鹵化銀AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲線如圖示.橫坐標p(Ag+)表示“-lgc(Ag+)”,縱坐標Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列說法正確的是( )
一定溫度下,鹵化銀AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲線如圖示.橫坐標p(Ag+)表示“-lgc(Ag+)”,縱坐標Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列說法正確的是( )| A. | a點表示c(Ag+)=c(CrO42-) | |
| B. | b點可表示AgI的飽和溶液 | |
| C. | 該溫度下AgI的Ksp約為1×10-16 | |
| D. | 該溫度下AgCl、AgBr飽和溶液中:c(Cl-)<c(Br-) |
分析 A.a點為Ag2CrO4飽和溶液,存在Ag2CrO4(s)?2Ag+(aq)+CrO42-(aq);
B.b點在AgI溶解平衡曲線的上方,為不飽和溶液;
C.橫坐標p(Ag+)表示“-lgc(Ag+)”,縱坐標Y表示“-lgc(I-)”,可計算Ksp;
D.縱橫坐標的乘積越大,Ksp越小.
解答 解:A.a點為Ag2CrO4飽和溶液,存在Ag2CrO4(s)?2Ag+(aq)+CrO42-(aq),則a點表示c(Ag+)≠c(CrO42-),故A錯誤;
B.b點在AgI溶解平衡曲線的上方,Qc<Ksp,為不飽和溶液,曲線上的點為飽和溶液,故B錯誤;
C.橫坐標p(Ag+)表示“-lgc(Ag+)”,縱坐標Y表示“-lgc(I-)”,該溫度下AgI的Ksp約為1×10-8×1×10-8=1×10-16,故C正確;
D.縱橫坐標的乘積越大,Ksp越小,則Ksp(AgCl)>Ksp(AgBr),可知該溫度下AgCl、AgBr飽和溶液中:c(Cl-)>c(Br-),故D錯誤;
故選C.
點評 本題考查難溶電解質的溶解平衡,為高頻考點,把握圖中離子濃度、Ksp的關系為解答的關鍵,側重分析與計算能力的考查,注意Ksp與縱橫坐標的關系,題目難度不大.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 硝酸工業是國民經濟的命脈產業,工業制硝酸通常是如下過程:
硝酸工業是國民經濟的命脈產業,工業制硝酸通常是如下過程:| 化學鍵 | N≡N | H-H | N-H |
| 鍵能/kJ/mol | a | b | c |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
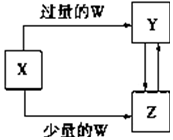 已知X、Y、Z、W均為中學化學中常見的單質或化合物,它們之間的轉化關系如圖所示(部分產物已略去).則W、X不可能是( )
已知X、Y、Z、W均為中學化學中常見的單質或化合物,它們之間的轉化關系如圖所示(部分產物已略去).則W、X不可能是( )| 選項 | W | X |
| A | 稀硫酸 | NaAlO2溶液 |
| B | 稀硝酸 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | Cl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
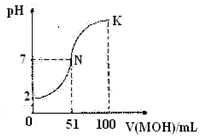
| A. | 在N到K間任意一點對應的溶液中:c(M+)+c(H+)=c(OHˉ)+c(Aˉ) | |
| B. | HA為弱酸 | |
| C. | 常溫下,MA溶液的pH>7 | |
| D. | N點水的電離程度小于K點水的電離程度 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com