
【題目】鋰-銅空氣燃料電池容量高、成本低,具有廣闊的發展前景。該電池工作時發生復雜的銅腐蝕現象,電池總反應為:2Li+Cu2O+H2O=2Cu+2Li++2OH-,其工作原理如圖所示,下列說法不正確的是( )
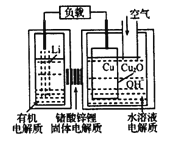
A. 電池放電時,正極附近溶液pH增大
B. 工作時,Li′透過固體電解質向Cu極移動
C. 電池放電過程中,空氣中的O2并不參加反應
D. 兩極的有機電解質和水溶液電解質不可對換
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】根據某有機物的結構:
(1)測定實驗式:某含碳、氫、氧三種元素的有機物,經燃燒分析實驗測定其碳的質量分數是64.86%,氫的質量分數是13.51%,則其實驗式是________。
(2)確定分子式:下圖是該有機物的質譜圖,則其相對分子質量為______,分子式為________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A是一種氣態烴,相對分子質量是28,通常用作果實催熟劑,其年產量可用來衡量一個國家石油化工發展水平。D是廚房中某種調味品的成分之一, 各物質間的轉化關系如下圖(反應條件已省略)。回答下列問題:
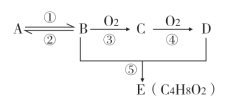
(1)B物質的名稱________________.
(2)D分子中含有的官能團名稱________________________.
(3)C物質的結構簡式________________________
(4)反應⑤發生的條件________________________
(5)反應④的反應類型________________________
(6)反應①的化學方程式:________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物甲和A互為同分異構體,經測定它們的相對分子質量小于100;將1mol甲在O2中充分燃燒得到等物質的量的CO2和H2O (g) ,同時消耗112L O2(標準狀況);在酸性條件下將1mol甲完全水解可以生成1mol乙和1mol丙;而且在一定條件下,丙可以被連續氧化成為乙。
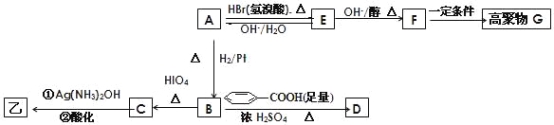
經紅外光譜測定,在甲和A的結構中都存在C=O雙鍵和C-O單鍵,B在HIO4存在并加熱時只生成一種產物C,下列為各相關反應的信息和轉化關系:
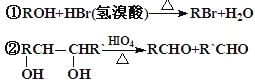
⑴ 請確定并寫出甲的分子式_______;與甲屬同類物質的同分異構體共有____種(包含甲)。
⑵ E→F 的反應類型為_________反應;
⑶ A的結構簡式為_________;G 的結構簡式為_________;
⑷ B→D的反應化學方程式為_______________________________;
⑸ 寫出C在條件①下進行反應的化學方程式___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳和氮的氫化物是廣泛的化工原料,回答下列問題:
(1)工業上合成氨的反應為N2(g)+3H2(g)![]() 2NH3(g) △H=-92.2kJ/mol,反應過程中能量變化如圖I所示。
2NH3(g) △H=-92.2kJ/mol,反應過程中能量變化如圖I所示。

①氨分解:2NH3(g)![]() N2(g)+3H2(g)的活化能為_________kJ/mol
N2(g)+3H2(g)的活化能為_________kJ/mol
②合成氨時加入鐵粉可以加快生成NH3的速率,在圖I中畫出加入鐵粉后的能量變化曲線。_______
(2)聯氨作火箭燃料的反應為:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H1
已知:2O2(g)+N2(g)=N2O4(1) △H2 N2H4(1)+O2(g)=N2(g)+2H2O(g) △H3
上述熱效應之間的關系式為△H1=____。某新型火箭用液氧/煤油代替聯氨/N2O4,這種替換可能的好處是___(一條即可)。
(3)天然氣制氫氣是工業上制氫氣的主要方法之一,其主要反應如下:
i.CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=-+206.4kJ/mol,
CO(g)+3H2(g) ΔH=-+206.4kJ/mol,
ii.CO(g)+ H2O(g)![]() CO2(g)+H2(g) ΔH=-41.0kJ/mol
CO2(g)+H2(g) ΔH=-41.0kJ/mol
在一定溫度下,2L的密閉容器中加入a molCH4和2amolH2O發生反應,t min時反應達平衡,測得容器內CObmol、CO2cmol。回答下列問題:
①下列可判斷體系達到平衡狀態的是_______。
A.CO的體積分數不變 B.容器內氣體密度不變 C.3v(CH4)=v(H2) D.![]() 不再變化
不再變化
②0~tmin反應速率v(CO2)=_____,CH4的的轉化率為_____,反應ⅱ的平衡常數K=______。
③圖Ⅱ中T℃之后c(CO2)隨溫度升高而減小的原因是_________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學--有機化學基礎】有機物G(![]() )是一種調香香精,可用作抗氧劑,工業上合成它的路線圖之一如下:
)是一種調香香精,可用作抗氧劑,工業上合成它的路線圖之一如下:

(1)A中官能團的名稱是_____,B→C的反應類型為_________。
(2)G分子中一定共平面的碳原子有______個。
(3)反應F→G中消耗的F與CH3MgBr的物質的量之比為______,B在濃硫酸存在下加熱可通過一步反應得到E物質,但合成不采用此方法,其原因是__________。
(4)C→D的化學方程式為_______________。
(5)E有多種同分異構體,其中滿足下列條件的同分異構體有_____種,寫出核磁共振氫譜有4個吸收蜂的物質的結構簡式:_______。
①含有一個六元環 ②1mol同分異構體與足量銀氨溶液發生銀鏡反應生成4 mol Ag
(6)已知A轉化為B的原理與F轉化為G的相似,請設計以A為起始原料(其他試劑任選)制備![]() 的合成路線______________。
的合成路線______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】雙羥基鋁碳酸鈉是醫療上常用的一種抑酸劑,其化學式是NaAl(OH)2CO![]() 。關于該物質的說法正確的是( )
。關于該物質的說法正確的是( )
A. 該物質屬于兩性氫氧化物
B. 該物質是Al(OH)3和Na2CO3的混合物
C. 1 mol NaAl(OH)2CO3最多可消耗3 mol H![]()
D. 該藥劑不適合于胃潰瘍患者服用
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能源開發、環境保護、資源利用等是當今社會的熱門話題。請根據所學化學知識回答下列問題:
(1)汽車上安裝催化轉化器,可使汽車尾氣中的主要污染物(CO、NOx、碳氫化合物)進行相互反應,生成無毒物質,減少汽車尾氣污染。
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ · mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ · mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ · mol-1;
則尾氣轉化反應2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)汽車尾氣分析儀對CO的含量分析是以燃料電池為工作原理,其裝置如下圖所示,該電池中電解質為氧化釔-氧化鈉,其中O2-可以在固體介質中自由移動。

下列說法中正確的是_____________(填字母序號)。
A.負極的電極反應式為:CO + O2-―2e-=CO2
B.工作時電子由電極a通過傳感器流向電極b
C.工作時電極b作正極,O2-由電極a通過固體介質向電極b遷移
D.傳感器中通過的電流越大,尾氣中CO的含量越高
(3)某硝酸廠利用甲醇處理廢水。在一定條件下,向廢水中加入CH3OH,將HNO3還原成N2。若該反應消耗32 g CH3OH轉移6 mol電子,則參加反應的還原劑和氧化劑的物質的量之比為______________。
(4)煤的間接液化是先轉化為CO和H2,再在催化劑作用下合成甲醇。若在一定溫度下,向1 L密閉容器中加入CO和H2,發生反應CO(g)+2H2(g)![]() CH3OH(g),經10 min反應達到平衡時測得各組分的濃度如下:
CH3OH(g),經10 min反應達到平衡時測得各組分的濃度如下:
物 質 | CO | H2 | CH3OH |
濃度/(mol·L-1) | 1.2 | 1.0 | 0.6 |
①該反應的平衡常數表達式為:K=_____________________。
②該時間內反應速率υ(H2)=_________________。
③平衡時CO的轉化率為_________________(保留1位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列幾種導電性變化圖像,把符合要求的圖像序號填在相應的題目后面括號中。
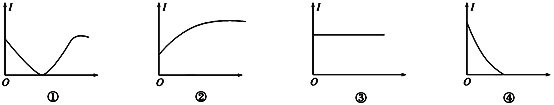
(1)向H2SO4溶液中加入等體積、等物質的量濃度的Ba(OH)2溶液(______)
(2)向H2SO4溶液中通入Cl2直至過量(______)
(3)向AgNO3溶液通入少量HCl(______)
(4)向氨水中通入HCl直至過量(______)
(5)向NaOH溶液中通入少量Cl2(______)
(6)向飽和石灰水中不斷通入CO2(______)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com