
以下物質的分離方法錯誤的是
A.將碘和四氯化碳分離:蒸餾 B.除去苯中混有的苯酚:加入濃溴水,過濾
C.煤焦油和粗氨水的分離:分液 D.分離溶液中微量的Fe3+ 和Cu2+:紙上層析
科目:高中化學 來源: 題型:
| 選項 | a | b | c | d |
| x | 溫度 | 溫度 | 加入H2的物質的量 | 加入NH3的物質的量 |
| y | NH3的物質的量 | 平衡常數K | NH3的轉化率 | 生成物物質的量總和 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
(14分,每空2分)
I.合成氨工業對國民經濟和社會發展具有重要的意義。其原理為:
N2(g)+3H2(g) 2NH3(g) △H= -92.4 kJ/mol 據此回答以下問題:
(1)為了提高氨氣的產率,可以選擇的方法是 _______ (填序號,錯選扣分)。
① 升高溫度 ② 增大壓強 ③ 使用催化劑 ④ 及時分離出NH3
(2)對在密閉容器中進行的可逆反應:N2(g)+3H2(g)2NH3(g),下列哪種情況下,
說明該反應已經達到化學平衡狀態____________________________________。
①N2的正反應速率是NH3的逆反應速率的1/2
②在恒容條件下,混合氣體的壓強保持不變
③N2、H2、NH3的物質的量之比為1:3:2
④單位時間內每生成3mol H2的同時有2mol NH3生成
⑤3mol N-N鍵斷裂,同時有6mol N-H鍵斷裂
(3)一定條件下,NH3在固定體積的密閉容器中發生分解反應(△H>0)并達平衡后,僅改變下表中反應條件x,該平衡體系中隨x遞增y遞減的是________________(選填序號)。
| 選項 | a | b | c | d |
| x | 溫度 | 溫度 | 加入H2的物質的量 | 加入NH3的物質的量 |
| y | NH3的物質的量 | 平衡常數K | NH3的轉化率 | 生成物物質的量總和 |
II.(1)在酸性溶液中,碘酸鉀(KIO3)和亞硫酸鈉可發生如下反應:
2IO3-+5SO32-+2H+===I2+5SO42-+H2O
生成的碘可以用淀粉溶液檢驗,根據反應溶液出現藍色所需的時間來衡量該反應的速率。
某同學設計實驗如下表所示:
|
| 0.01mol·L-1 KIO3酸性溶液(含淀粉)的體積/mL | 0.01mol·L-1 Na2SO3溶液的體積/mL | H2O的體積 /mL | 實驗 溫度 /℃ | 溶液出現藍色時所需時間/s |
| 實驗1 | 5 | V1 | 35 | 25 | --------- |
| 實驗2 | 5 | 5 | 40 | 25 | ---------- |
| 實驗3 | 5 | 5 | V2 | 0 | ----------- |
該實驗的目的是_______________________________________________________________
________________________________________________;
表中V1=___________mL.
(2)可逆反應C(s)+H2O(g) H2(g)+CO(g),△H>0達到平衡后,改變某一外界條件(不改變物質的量的條件下),反應速率
![]() 與時間t的關系如右圖。
與時間t的關系如右圖。
①圖中t4到t6段時引起平衡移動的條件可能是 ;
②圖中表示平衡混合物中CO的含量最高的一段時間是 。

查看答案和解析>>
科目:高中化學 來源:2011-2012年學福建省永安一中高二上學期期中考試化學試卷 題型:填空題
(14分,每空2分) I.合成氨工業對國民經濟和社會發展具有重要的意義。其原理為:
I.合成氨工業對國民經濟和社會發展具有重要的意義。其原理為:
N2(g)+3H2 (g)
(g)  2NH3(g) △H=" -92.4" kJ/mol 據此回答以下問題:
2NH3(g) △H=" -92.4" kJ/mol 據此回答以下問題:
(1)為了提高氨氣的產率,可以選擇的方法是 _______(填序號,錯選扣分)。
① 升高溫度 ② 增大壓強 ③ 使用催化劑 ④ 及時分離出NH3
(2)對在密閉容器中進行的可逆反應:N2(g)+3H2(g) 2NH3(g),下列哪種情況下,
2NH3(g),下列哪種情況下,
說明該反應已經達到化學平衡狀態____________________________________。
①N2的正反應速率是NH3的逆反應速率的1/2
②在恒容條件下,混合氣體的壓強保持不變
③N2、H2、NH3的物質的量之比為1:3:2
④單位時間內每生成3mol H2的同時有2mol NH3生成
⑤3mol N-N鍵斷裂,同時有6mol N-H鍵斷裂
(3)一定條件下,NH3在固定體積的密閉容器中發生分解反應(△H>0)并達平衡后,僅改變下表中反應條件x,該平衡體系中隨x遞增y遞減的是________________(選填序號)。
| 選項 | a | b | c | d |
| x | 溫度 | 溫度 | 加入H2的物質的量 | 加入NH3的物質的量 |
| y | NH3的物質的量 | 平衡常數K | NH3的轉化率 | 生成物物質的量總和 |
| | 0.01mol·L-1 KIO3酸性溶液(含淀粉)的體積/mL | 0.01mol·L-1 Na2SO3溶液的體積/mL | H2O的體積 /mL | 實驗 溫度 /℃ | 溶液出現藍色時所需時間/s |
| 實驗1 | 5 | V1 | 35 | 25 | --------- |
| 實驗2 | 5 | 5 | 40 | 25 | ---------- |
| 實驗3 | 5 | 5 | V2 | 0 | ----------- |
 H2(g)+CO(g),△H>0達到平衡后,改變某一外界條件(不改變物質的量的條件下),反應速率
H2(g)+CO(g),△H>0達到平衡后,改變某一外界條件(不改變物質的量的條件下),反應速率 與時間t的關系如右圖。
與時間t的關系如右圖。 ;
;
查看答案和解析>>
科目:高中化學 來源:2011-2012年學福建省高二上學期期中考試化學試卷 題型:填空題
(14分,每空2分)
I.合成氨工業對國民經濟和社會發展具有重要的意義。其原理為:
N2(g)+3H2(g)
 2NH3(g) △H= -92.4 kJ/mol 據此回答以下問題:
2NH3(g) △H= -92.4 kJ/mol 據此回答以下問題:
(1)為了提高氨氣的產率,可以選擇的方法是 _______ (填序號,錯選扣分)。
① 升高溫度 ② 增大壓強 ③ 使用催化劑 ④ 及時分離出NH3
(2)對在密閉容器中進行的可逆反應:N2(g)+3H2(g) 2NH3(g),下列哪種情況下,
2NH3(g),下列哪種情況下,
說明該反應已經達到化學平衡狀態____________________________________。
①N2的正反應速率是NH3的逆反應速率的1/2
②在恒容條件下,混合氣體的壓強保持不變
③N2、H2、NH3的物質的量之比為1:3:2
④單位時間內每生成3mol H2的同時有2mol NH3生成
⑤3mol N-N鍵斷裂,同時有6mol N-H鍵斷裂
(3)一定條件下,NH3在固定體積的密閉容器中發生分解反應(△H>0)并達平衡后,僅改變下表中反應條件x,該平衡體系中隨x遞增y遞減的是________________(選填序號)。
|
選項 |
a |
b |
c |
d |
|
x |
溫度 |
溫度 |
加入H2的物質的量 |
加入NH3的物質的量 |
|
y |
NH3的物質的量 |
平衡常數K |
NH3的轉化率 |
生成物物質的量總和 |
II.(1)在酸性溶液中,碘酸鉀(KIO3)和亞硫酸鈉可發生如下反應:
2IO3-+5SO32-+2H+===I2+5SO42-+H2O
生成的碘可以用淀粉溶液檢驗,根據反應溶液出現藍色所需的時間來衡量該反應的速率。
某同學設計實驗如下表所示:
|
|
0.01mol·L-1 KIO3酸性溶液(含淀粉)的體積/mL |
0.01mol·L-1 Na2SO3溶液的體積/mL |
H2O的體積 /mL |
實驗 溫度 /℃ |
溶液出現藍色時所需時間/s |
|
實驗1 |
5 |
V1 |
35 |
25 |
--------- |
|
實驗2 |
5 |
5 |
40 |
25 |
---------- |
|
實驗3 |
5 |
5 |
V2 |
0 |
----------- |
該實驗的目的是_______________________________________________________________
________________________________________________;
表中V1=___________mL.
(2)可逆反應C(s)+H2O(g)  H2(g)+CO(g),△H>0達到平衡后,改變某一外界條件(不改變物質的量的條件下),反應速率
H2(g)+CO(g),△H>0達到平衡后,改變某一外界條件(不改變物質的量的條件下),反應速率 與時間t的關系如右圖。
與時間t的關系如右圖。
①圖中t4到t6段時引起平衡移動的條件可能是 ;
②圖中表示平衡混合物中CO的含量最高的一段時間是 。
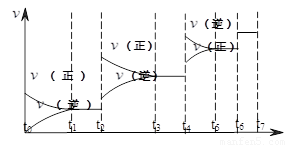
查看答案和解析>>
科目:高中化學 來源:2012-2013學年福建省三明一中高二(上)期中化學試卷(理科)(解析版) 題型:解答題
| 選項 | a | b | c | d |
| x | 溫度 | 溫度 | 加入H2的物質的量 | 加入NH3的物質的量 |
| y | NH3的物質的量 | 平衡常數K | NH3的轉化率 | 生成物物質的量總和 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com