
①加熱
②滴入稀硫酸
③加入新制的氫氧化銅懸濁液
④加入適量的氫氧化鈉溶液調節至堿性
A. ①→②→③→④→① B. ③→④→①→②→①
C. ②→④→①→③→① D. ②→①→④→③→①
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2015-2016學年河北省滄州市高一下期中化學試卷(解析版) 題型:選擇題
氮化鋁(AlN)具有耐高溫、抗沖擊、導熱性好等優良性質,被廣泛應用于電子工業、陶瓷工業等領域.在一定條件下,氮化鋁可通過如下反應合成:Al2O3+N2+3C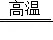 2AlN+3CO.下列敘述正確的是( )
2AlN+3CO.下列敘述正確的是( )
A.在氮化鋁的合成反應中,N2是還原劑,Al2O3是氧化劑
B.上述反應中每生成2 mol AlN,N2得到3 mol電子
C.氮化鋁中氮元素的化合價為﹣3
D.氮化鋁晶體屬于分子晶體
查看答案和解析>>
科目:高中化學 來源:2015-2016學年廣東省高二下第一次段考文科化學試卷(解析版) 題型:選擇題
1L 0.1mol•L﹣1的K2SO4溶液中( )
A.K+的物質的量為0.1mol
B.SO42﹣的物質的量為0.2mol
C.K+的物質的量濃度為0.1mol.L﹣1
D.SO42﹣的物質的量濃度為0.1mol.L﹣1
查看答案和解析>>
科目:高中化學 來源:2015-2016學年廣東省高二下第一次段考文科化學試卷(解析版) 題型:選擇題
泡菜腌制過程中產生NaNO2,NaNO2中的N元素的化合價為( )
A.+2 B.+3 C.+4 D.+5
查看答案和解析>>
科目:高中化學 來源:2015-2016學年海南省高二下學期期末考試化學試卷(解析版) 題型:填空題
琥珀酸二乙酯是良好的增塑劑和特種潤滑劑,也是重要的有機合成的中間體。分析下圖中物質間的轉化關系,回答問題。

已知:RCN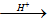 RCOOH
RCOOH
(1)B的結構簡式為 。
(2)C的同分異構體中,與C具有相同官能團的是 (寫結構簡式)。
(3)由C制備琥珀酸二乙酯的化學方程式為: 。
(4)若E為高分子化合物,則由C與D制備E的化學方程式為 。
(5)若E為八元環狀化合物,其分子式為 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年海南省高二下學期期末考試化學試卷(解析版) 題型:選擇題
可以證明乙醇分子中有一個氫原子與另外氫原子不同的方法是( )
A.1 mol乙醇燃燒生成3 mol水
B.乙醇可以制飲料
C.乙醇代替汽油做燃料,污染小,更環保
D.1 mol乙醇跟足量的Na作用得0.5 mol H2
查看答案和解析>>
科目:高中化學 來源:2015-2016學年廣東省廣州市南沙區高一下學期期末考試化學試卷(解析版) 題型:填空題
在2L密閉容器中進行反應:mX(g)+nY(g)?pZ(g)+qQ(g),式中m、n、p、q為化學計量數.在0~3min內,各物質物質的量的變化如下表所示:
物質 | X | Y | Z | Q |
時間 | ||||
起始/mol | 0.7 | 1 | ||
2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3min末/mol | 0.8 |
已知:2min內v(Q)=0.075mol•L﹣1•min﹣1,v(Z):v(Y)=1:2。
(1)2min內Z的反應速率v(Z)=_______________________。
(2)試確定以下物質的相關量:起始時n(Y)=______,n(Q)=______。
(3)方程式中m=______,n=______,p=______,q=______。
(4)對于該反應,能增大正反應速率的措施是___________
A.增大容器體積 B.移走部分Q C.通入大量X D.升高溫度
(5)該反應達到化學平衡狀態時___________
A.反應停止了
B.正反應速率與逆反應速率均為0
C.反應物與生成物濃度相等
D.正反應速率與逆反應速率相等
查看答案和解析>>
科目:高中化學 來源:2015-2016學年廣東省廣州市南沙區高一下學期期末考試化學試卷(解析版) 題型:選擇題
元素周期表中某區域的一些元素多用于制造半導體材料,它們是( )
A. 稀有氣體元素
B. 左下方區域的金屬元素
C. 右上方區域的非金屬元素
D. 金屬元素和非金屬元素分界線附近的元素
查看答案和解析>>
科目:高中化學 來源:2015-2016學年福建省高二下學期期末考試化學試卷(解析版) 題型:填空題
氨、硫、氯及其化合物對環境有著重要的影響,在化工生產和日常生活中的用途也十分廣泛,如用做漂白劑、沉淀劑、農藥、化肥等。
(1)以N2 和H2 為原料合成氫氣為: N2(g) + 3 H2(g)  2NH3(g) △H=Q kJ•mol—1。已知鍵鍵能為946 kJ•mol—1 ,H-H鍵鍵能為436kJ• mol—1,N-H鍵鍵能為391kJ• mol—1,則Q=_______。
2NH3(g) △H=Q kJ•mol—1。已知鍵鍵能為946 kJ•mol—1 ,H-H鍵鍵能為436kJ• mol—1,N-H鍵鍵能為391kJ• mol—1,則Q=_______。
(2)將體積均為560 mL(標準狀況下)的SO2 和Cl2 同時緩慢通A水中,得到1.0 L溶液,則溶液pH=_______。
(3)物質的量濃度相等的NH4HSO3溶液和NaHSO3 溶液中,陰離子的電離程度較小的是__________(填化學式),原因是___________ 。
(4)用惰性電極電解NaHSO3 溶液的裝置如圖所示,則I是___________(填化學式,下同),陽極區放出的混合氣體的成分為___________。
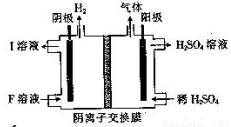
(5)氨水是一種常見的沉淀劑。向1.0 L 2.0×10—4mol•L—1的MgCl2 溶液中通入(不考慮溶液體積的變化),有白色沉淀生成。
①寫出生成白色沉淀的離子方程式____________________.
②當反應中開始有白色沉淀出現時,通人的體積(標準狀況)為___________mL。
(已知實驗條件下NH3.H2O的電離平衡常數為1.8×l0—5,Ksp=[Mg(OH)2]=1.8×l0—11)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com