
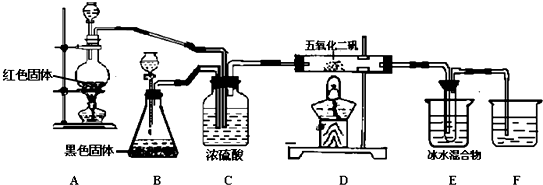
分析 裝置A為紅色銅和濃硫酸加熱反應生成硫酸銅、二氧化硫和水,裝置B是過氧化氫在黑色固體二氧化錳催化劑作用下分解生成水和氧氣,二氧化硫和氧氣按照一定比例通過裝置C除去氣體中的水蒸氣,進入裝置D在V2O5作用下發生氧化還原反應生成三氧化硫,三氧化硫在裝置E中冰水冷卻使三氧化硫變化為固體,剩余氣體通入裝置F吸收,避免污染空氣,
(1)裝置B中黑色固體為二氧化錳是催化劑,在二氧化錳作用下使過氧化氫分解生成水和氧氣;
(2)裝置C中的濃硫酸吸收氣體中的水蒸氣,起到干燥氣體的作用,同時可以觀察二氧化硫和氧氣的流速控制最佳比例,使氣體混合均勻;
(3)A處銅和濃硫酸加熱反應生成二氧化硫的反應,D處是二氧化硫的催化氧化反應生成三氧化硫;
(4)三氧化硫在溫度低的條件下變化為固體,分離出三氧化硫.
解答 解:(1)裝置B中黑色固體為二氧化錳是催化劑,在二氧化錳作用下使過氧化氫分解生成水和氧氣,反應的化學方程式為:2H2O2$\frac{\underline{\;催化劑\;}}{\;}$2H2O+O2↑,
故答案為:2H2O2$\frac{\underline{\;催化劑\;}}{\;}$2H2O+O2↑;
(2)裝置C中的濃硫酸吸收氣體中的水蒸氣,起到干燥氣體的作用,同時可以觀察二氧化硫和氧氣冒出的氣泡控制氣體流速的最佳比例,使氣體混合均勻,
故答案為:干燥氣體、觀察氣體流速是二氧化硫和氧氣以最佳比混合、使氣體混合均勻;
(3)A處銅和濃硫酸加熱反應生成二氧化硫的反應,反應的化學方程式為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,D處是二氧化硫的催化氧化反應生成三氧化硫,反應的化學方程式為:2SO2+O2$?_{△}^{V_{2}O_{5}}$2SO3,
故答案為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,2SO2+O2$?_{△}^{V_{2}O_{5}}$2SO3;
(4)三氧化硫在溫度低的條件下變化為固體,分離出三氧化硫,E中冰水混合物的作用是使SO3冷卻成固體,
故答案為:使SO3冷卻成固體.
點評 本題考查了物質制備的實驗過程分析判斷,二氧化硫、三氧化硫的制備方法和實驗設計,注意試劑的選擇和作用分析,掌握基礎是解題關鍵,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:多選題
| A. | 標準狀況下,1.8g水中所含有氧原子數目為0.1NA | |
| B. | 常溫常壓下,2.24LCO2氣體中含氧原子數目為0.2NA | |
| C. | 0.1mol/LCuCl2溶液中,含有Cl-離子的數目為0.2NA | |
| D. | 常溫常壓下,23gNa+中含有的電子數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應①、②、③都是氧化還原反應 | |
| B. | 反應①中H2O2被還原 | |
| C. | 氧化性:KMnO4>O2 | |
| D. | 每生成1mol F2,上述反應共轉移2mol電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某同學用如圖所示裝置制取次氯酸鈉.圖中瓶乙盛飽和食鹽水,瓶丙盛濃硫酸,分液漏斗A中盛濃鹽酸.試完成下列問題:
某同學用如圖所示裝置制取次氯酸鈉.圖中瓶乙盛飽和食鹽水,瓶丙盛濃硫酸,分液漏斗A中盛濃鹽酸.試完成下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 物質 | X | Y | Z |
| 初始濃度/mol•L-1 | 0.1 | 0.2 | 0 |
| 2min末濃度/mol•L-1 | 0.08 | a | b |
| 平衡濃度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 平衡時,X的轉化率為20% | |
| B. | t℃時,該反應的平衡常數為40 | |
| C. | 前2 min內,用Y的變化量表示的平均反應速率v(Y)=0.03 mol•L-1•min-1 | |
| D. | 增大平衡后的體系壓強,v正增大,v逆減小,平衡向正反應方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com