
化工生產中常用到“三酸兩堿”,“三酸”指硝酸、硫酸和鹽酸,“兩堿”指燒堿和純堿。
(1)“三酸”與“兩堿”之間均可反應,酸過量時, 若用化學方程式表示有六個,若用離子方程式表示卻只有兩個,一個是H++OH-=H2O,請寫出另一個離子方程式: 。
(2) 實驗室制備H2、CO2、NH3、SO2時,用鹽酸和稀硫酸可制備的相同氣體是_______。
(3)燒堿、純堿溶液均可吸收CO2,當含0.1 mol NaOH的溶液吸收一定量CO2后,將溶液低溫小心蒸干得到固體的組成可能有四種情況,分別是(填化學式):
① ;②Na2CO3;③Na2CO3和NaHCO3;④NaHCO3。
(4)將(3)得到的固體重新溶解于水,向其中加入鹽酸,調節溶液的pH恰好等于7,再將溶液蒸干,最終得到固體的質量為 g。
(5)利用侯德榜制堿法可制兩堿的一種,請寫出制取小蘇打時在溶液中發生反應的總化學方程式 。
(1)CO32-+2H+=H2O+CO2↑ (2分)
(2)H2(2分)
(3)Na2CO3和NaOH (2分)
(4)5.85g (2分)
(5)H2O+CO2+NaCl+NH3=NaHCO3↓+NH4Cl (2分)
解析試題分析:(1)碳酸鈉因其水溶液顯現堿性而俗稱純堿。在物質的分類上屬于鹽。酸都電離產生氫離子H+,氫氧化鈉電離產生OH-, Na2CO3電離產生CO32-,故發生上述兩個離子反應,除了H++OH-=H2O,肯定有純堿Na2CO3,寫離子方程式應該是CO32-+2H+=H2O+CO2↑。
(2) 實驗室制備H2用鹽酸和稀硫酸可制備、實驗室制備CO2只能用鹽酸和碳酸鈣制備,不能用稀硫酸、NH3實驗室制備用氯化銨和氫氧化鈣固體、SO2實驗室制備用Na2SO3和濃硫酸,綜上所述,相同氣體是氫氣。
(3)在NaOH溶液中通人一定量的CO2后,溶液中的溶質的組成分析:用數軸表示為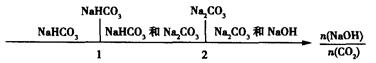
當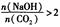 時,溶質的組成為NaOH和Na2CO3;當
時,溶質的組成為NaOH和Na2CO3;當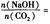 2時,溶質的組成為Na2CO3;當
2時,溶質的組成為Na2CO3;當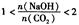 時,溶質的組成為Na2CO3和NaHCO3;當
時,溶質的組成為Na2CO3和NaHCO3;當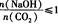 時,溶質的組成為NaHCO3。
時,溶質的組成為NaHCO3。
(4)將(3)得到的固體重新溶解于水,向其中加入鹽酸,調節溶液的pH恰好等于7,說明全部轉變成了氯化鈉,氯化鈉和氫氧化鈉的物質的量相等,0.1 mol 氯化鈉的質量為5.85gg。
(5)侯氏制堿法原理,是依據離子反應發生的原理進行的,離子反應會向著離子濃度減小的方向進行。要制純堿,先制得溶解度較小的NaHCO3。再利用碳酸氫鈉不穩定性分解得到純堿。要制得碳酸氫鈉就要有大量鈉離子和碳酸氫根離子,所以就在飽和食鹽水中通入氨氣,形成飽和氨鹽水,再向其中通入二氧化碳,在溶液中就有了大量的鈉離子,銨根離子,氯離子和碳酸氫根離子,這其中NaHCO3溶解度最小,所以析出,其余產品處理后可作肥料或循環使用。反應方程式為H2O+CO2+NaCl+NH3=NaHCO3↓+NH4Cl。
考點:考查離子方程式的書寫及化學計算等。


 舉一反三同步巧講精練系列答案
舉一反三同步巧講精練系列答案 口算與應用題卡系列答案
口算與應用題卡系列答案 名師點睛字詞句段篇系列答案
名師點睛字詞句段篇系列答案科目:高中化學 來源: 題型:單選題
下列有關物質性質和應用敘述正確并且有因果關系的是
| A.燒堿具有堿性,能用于治療胃酸過多 |
| B.焦炭具有還原性,一定條件下能將二氧化硅還原為硅 |
| C.濃硝酸具有強氧化性,能和濃氨水反應產生白煙 |
| D.二氧化硫具有漂白性,與氯水混合使用漂白效果更好 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
有五種摩爾質量均為44g/mol的化合物甲、乙、丙、丁、戊,均由短周期元素組成。對甲的捕獲在降低溫室氣體排放中具有重要的作用。乙為烴,等物質的量的乙與丁充分燃燒產物為甲與水,且生成水的質量前者是后者的2倍,丙在一定條件下分解獲得兩種單質,兩單質放電時反應生成A,A遇空氣變成紅棕色氣體B。戊是一種極不穩定的物質,在1180℃以下不存在。科學家用質譜儀在工業制硅的反應產物中證實了其存在。
(1)丁的分子式 ,甲的電子式 。
(2)若生成戊的反應中氧化產物與還原產物為同一物質,寫出生成戊的化學方程式 。
(3)把鐵和銅混和物放入一定量B通入水后形成的稀溶液中,反應后過濾,濾出的固體物質投入鹽酸中無氣體放出,則濾液中一定含有的溶質是 。
(4)將0.2mol乙完全燃燒后生成的氣體全部緩慢通入300mL某濃度的NaOH溶液中,氣體完全被吸收,溶液中NaOH無剩余,則NaOH溶液的濃度為 (若有定值則寫具體數值,無定值則寫范圍)。
(5)將等物質的量A、B的混合物溶于NaOH溶液中得到只含有一種溶質的溶液,此溶質的化學式為 ,設計簡單實驗方案證明溶液中含有此溶質 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知甲、乙、丙分別代表中學化學中的常見物質,請根據題目要求回答下列問題:
Ⅰ.若甲的化學式為RCl3,其溶液在加熱蒸干并灼燒時可發生反應:
a.甲+H2O 乙+丙 b.乙
乙+丙 b.乙 氧化物+H2O
氧化物+H2O
①若甲為某用途廣泛的金屬元素的氯化物,其溶液在上述變化中生成的氧化物為紅棕色粉末,則甲發生a反應的化學方程式為:
②若甲為某短周期金屬元素的氯化物,則該金屬在周期表中的位置是: ;
若向30 mL 1 mol/L的甲的溶液中逐漸加入濃度為4 mol/L的NaOH溶液,若產生0.78 g白色沉淀,則加入的NaOH溶液的體積可能為 (選填編號).
| A.3 mL | B.7.5 mL | C.15 mL | D.27.5 mL |
 丙。則:
丙。則:
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
將磷肥生產中形成的副產物石膏(CaSO4·2H2O)轉化為硫酸鉀肥料和氯化鈣水合物儲熱材料,無論從經濟效益、資源綜合利用還是從環境保護角度看都具有重要意義。以下是石膏轉化為硫酸鉀和氯化鈣的工藝流程示意圖。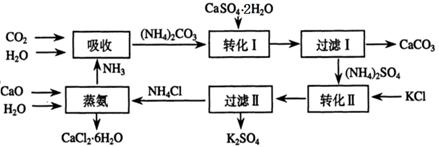
(1)本工藝中所用的原料除CaSO4·2H2O、KCl外,還需要______________等原料。
(2)石膏懸濁液中加入碳酸銨溶液后發生反應的離子方程式為_____________。
(3)過濾Ⅰ操作所得固體中,除CaCO3外還含有 (填化學式)等物質,該固體可用作生產水泥的原料。
(4)檢驗過濾Ⅰ所得濾液中含有CO32-的方法是_____________________________。
(5)氯化鈣結晶水合物(CaCl2·6H2O)是目前常用的無機儲熱材料,選擇的依據是___。
a.熔點較低(29℃熔化) b.能導電 c.能制冷 d.無毒
(6)上述工藝流程中體現綠色化學理念的是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
Ⅰ:某些化學反應可表示為:A+B→C+D+H2O,請回答下列問題:
(1)若A、C、D均是鐵的化合物,B是稀硫酸,則A與B反應的化學方程式為
(2)若A、C、D均含有氯元素,且A中氯元素的化合價介于C與D之間,該反應離子方程式為 。
(3)若A為淡黃色固體,C為無色的氣體,則該反應的離子方程式為 。
Ⅱ:某些化學反應可表示為:A+NaOH+H2O→C+D。請回答下列問題:
(1)若A為金屬單質,C為非金屬單質,寫出符合要求的離子方程式_____________________
(2)若A為非金屬單質,C為非金屬單質,寫出符合要求的化學反應方程式
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
完成以下離子方程式或化學方程式:
(1)實驗室制備氯氣的離子方程式
(2)實驗室制備氫氧化鋁的離子方程式
(3)實驗室制備氨氣的化學方程式
(4)在實驗室制備Fe(OH)2的過程中,常會出現白色沉淀迅速變成灰綠色,緩慢變成紅褐色的現象。寫出這步變化的化學方程式
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
黃銅礦(CuFeS2)是制取銅及其化合物的主要原料之一,還可以制備硫及鐵的化合物。
(1)冶煉銅的反應為8CuFeS2+21O2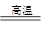 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合價為+2,反應中被還原的元素是 (填元素符號)。
(2)上述冶煉過程中產生大量SO2。下列處理方案合理的是 (填代號)。
a.高空排放 b.用于制備硫酸 c.用純堿溶液吸收制Na2SO3 d.用濃硫酸吸收
(3)利用黃銅礦冶煉銅產生的爐渣(含Fe2O3、FeO、SiO2、Al2O3)可制備Fe2O3。方法為
①用稀鹽酸浸取爐渣,過濾。
②濾液先氧化,再加入過量NaOH溶液,過濾,將沉淀洗滌、干燥、煅燒。
據以上信息回答下列問題:
a.除去Al3+的離子方程式是 。
b.選用提供的試劑,設計實驗驗證爐渣中含有FeO。
提供的試劑:稀鹽酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水。所選試劑為 。證明爐渣中含有FeO的實驗現象為 。
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列有關物質性質的比較正確的是
①同主族元素的單質從上到下,非金屬性減弱,熔點增高
②元素的最高正化合價在數值上等于它所在的族序數
③同周期主族元素的原子半徑越小,越難失去電子
④元素的非金屬性越強,它的氣態氫化物水溶液的酸性越強
⑤還原性:S2->Se2->Br->Cl-
⑥酸性:HClO4>H2SO4>H3PO4>H2SiO3
| A.①③ | B.②④ | C.③⑥ | D.⑤⑥ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com