
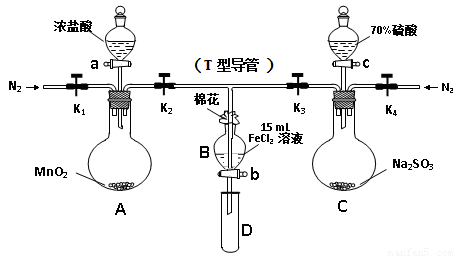
為驗證氧化性Cl2>Fe3+>SO2,某小組用下圖所示裝置進行實驗(夾持儀器和 A中加熱裝置已略,氣密性已檢驗)。
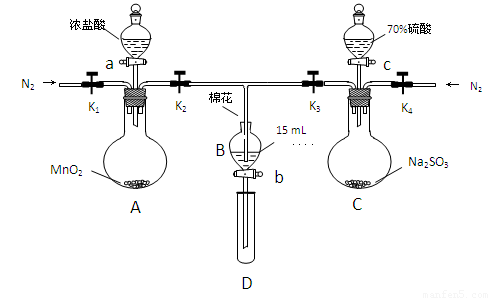
實驗過程:
Ⅰ.打開彈簧夾K1~K4,通入一段時間N2,再將T型導管插入B中,繼續通入N2,然后關閉K1、K3、K4。
Ⅱ.打開活塞a,滴加一定量的濃鹽酸,給A加熱。
Ⅲ.當B中溶液變黃時,停止加熱,夾緊彈簧夾K2。
Ⅳ.打開活塞b,使約2mL的溶液流入D試管中,檢驗其中的離子。
Ⅴ.打開彈簧夾K3、活塞c,加入70%的硫酸,一段時間后夾緊彈簧夾K3。
Ⅵ.更新試管D,重復過程Ⅳ,檢驗B溶液中的離子。
(1)A中發生反應的化學方程式為 。
(2)用70%的硫酸制取SO2,反應速率比用98%的硫酸快,原因是 。
(3)甲、乙、丙三位同學分別完成了上述實驗,他們的檢測結果一定能夠證明氧化性
Cl2>Fe3+>SO2的是 (填“甲”“乙”“丙”)。
|
|
過程Ⅳ B溶液中含有的離子 |
過程Ⅵ B溶液中含有的離子 |
|
甲 |
有Fe3+無Fe2+ |
有SO42- |
|
乙 |
既有Fe3+又有Fe2+ |
有SO42- |
|
丙 |
有Fe3+無Fe2+ |
有Fe2+ |
(4)進行實驗過程Ⅴ時,B中溶液顏色由黃色逐漸變為紅棕色,停止通氣,放置一段時間后溶液顏色變為淺綠色。
查閱資料:Fe2+(aq)+SO32-(aq) FeSO3(s)(墨綠色)
FeSO3(s)(墨綠色)
提出假設:FeCl3與 SO2的反應經歷了中間產物FeSO3,溶液的紅棕色是FeSO3(墨綠色)與FeCl3(黃色)的混合色。某同學設計如下實驗,證實該假設成立:

① 溶液E和F分別為 、 。
② 請用化學平衡原理解釋步驟3中紅棕色溶液顏色變為淺綠色的原因
。
(1)MnO2+4HCl(濃) MnCl2+Cl2↑+2H2O (2分)
MnCl2+Cl2↑+2H2O (2分)
(2)70%的硫酸中c(H+)比98%的硫酸大,因此反應速率更快。(2分)
(3)乙、丙 (2分)
(4)① Na2SO3(或可溶性亞硫酸鹽)、FeCl3 (2分,各1分)
② Fe3+ 消耗 SO32-,c(SO32-)減小,使平衡Fe2+(aq)+SO32-(aq) FeSO3(s)逆向移動,溶液顏色由紅棕色變為淺綠色 (2分)
FeSO3(s)逆向移動,溶液顏色由紅棕色變為淺綠色 (2分)
【解析】
試題分析:
⑵反應速率的影響因素有溫度、濃度、催化劑、接觸面積等,該題中只有濃度不同,濃硫酸溶液中溶質主要以硫酸分子形式存在,電離出的氫離子少、濃度低。
⑶該題的理論依據是氧化還原反應中氧化劑的氧化性強于氧化產物,也強于還原劑的氧化性;甲、B可能有存在溶解的氯氣氧化二氧化硫;乙、B中存在二價鐵離子三價鐵離子,說明氯氣的氧化性強于三價鐵離子,且沒有氯氣剩余;故后有硫酸根離子能說明三價鐵離子氧化性強于二氧化硫;丙、B中存在三價鐵離子,說明氯氣氧化性強于三價鐵離子;后生成了二價鐵離子,只能是三價鐵離子被二氧化硫還原,正確。
⑷根椐假設和實驗應先生成亞硫酸鐵,再和三氯化鐵混合,所以分別加入亞硫酸鈉溶液、氯化鐵溶液;溶液變為淺綠色說明生成了二價鐵離子,即2Fe3++SO32-+H2O=2Fe2++SO42-+2H+促使2Fe3++3H2O Fe(OH)3+3H+和SO32-+H2O
Fe(OH)3+3H+和SO32-+H2O HSO32-+OH-逆向進行,溶液變為淺綠色。
HSO32-+OH-逆向進行,溶液變為淺綠色。
考點:綜合化學實驗題,考查實驗的具體操作步驟、操作目的、原理、微粒的檢驗以及分析等有關問題。


 口算題天天練系列答案
口算題天天練系列答案科目:高中化學 來源:2013屆天津市十二校高三第二次模擬聯考化學試卷(帶解析) 題型:實驗題
為驗證氧化性Cl2 > Fe3+ > SO2,某小組用下圖所示裝置進行實驗(夾持儀器和A中加熱裝置已略,氣密性已檢驗)。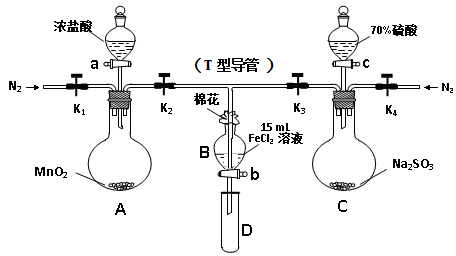
實驗過程:
Ⅰ.打開彈簧夾K1~K4,通入一段時間N2,再將T型導管插入B中, 繼續通入N2,然后關閉K1、K3、K4。
Ⅱ.打開活塞a,滴加一定量的濃鹽酸,加熱A。
Ⅲ.當B中溶液變黃時,停止加熱,夾緊K2。
Ⅳ.打開活塞b,使約2mL的溶液流入D試管中,并檢驗其中的離子。
Ⅴ.打開K3和活塞c,加入70%的硫酸,一段時間后夾緊K3。
Ⅵ.更新試管D,重復過程Ⅳ。
(1)過程Ⅰ的目的是 。
(2)棉花中浸潤的溶液為 。
(3)A中發生反應的化學方程式為 。
(4)能說明氧化性Fe3+ > SO2的離子方程式是 。
(5)過程Ⅵ,檢驗B溶液中是否含有SO42-的操作是 。
(6)甲、乙、丙三位同學分別完成了上述實驗,他們的檢測結果不能夠證明氧化性Cl2 > Fe3+ > SO2的是 (填“甲”“乙”“丙”),請用必要的文字說明理由 。
| | 過程Ⅳ B溶液中含有的離子 | 過程Ⅵ B溶液中含有的離子 |
| 甲 | 有Fe3+無Fe2+ | 有 Fe2+ |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+無Fe2+ | 有SO42- |
 FeSO3(s)(墨綠色)提出假設:FeCl3與 SO2的反應經歷了中間產物FeSO3,溶液的紅棕色是FeSO3(墨綠色)與FeCl3(黃色)的混合色。
FeSO3(s)(墨綠色)提出假設:FeCl3與 SO2的反應經歷了中間產物FeSO3,溶液的紅棕色是FeSO3(墨綠色)與FeCl3(黃色)的混合色。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年山東省泰安市高三上學期期末考試化學試卷(解析版) 題型:實驗題
為驗證氧化性Cl2>Fe3+>SO2,某小組用下圖所示裝置進行實驗(夾持儀器和甲中加熱裝置已略,氣密性已檢驗)。
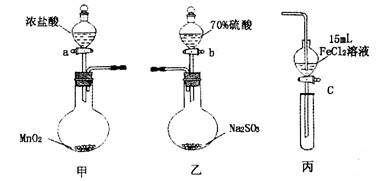
實驗步驟:
1.在甲裝置中,打開活塞a,加熱,待裝置中充滿黃綠色氣體時,與丙裝置連接。
2.當丙裝置中FeC12溶液變黃時,停止加熱。
3.打開活塞c,使約2mL的溶液滴入試管中,檢驗溶液中的離子。
4.在乙裝置中,打開活塞b,待空氣排盡后,將乙中產生的氣體通入上述丙裝置變黃后的溶液中,一段時間后,停止。
5.更新丙中試管,打開活塞c,使約2mL的溶液滴入試管中,檢驗溶液中的離子。
回答下列問題:
(1)甲中發生反應的化學方程式為______________________。
(2)用70%的硫酸制取SO2,反應速率比用98%的硫酸快,原因是____________。
(3)實驗中,證明氧化性Fe3+>SO2的離子方程式為_____________。
(4)有I、II、III三組同學分別完成了上述實驗,實驗結果如下:
|
|
步驟3溶液中含有的離子 |
步驟5溶液中含有的離子 |
|
I |
既有Fe3+又有Fe2+ |
有SO42- |
|
Ⅱ |
有Fe3+無Fe2+ |
有SO42- |
|
Ⅲ |
有Fe3+無Fe2+ |
有Fe2+ |
上述實驗結果一定能夠證明Cl2>Fe3+>SO2的是______(填“I”、“II”或“III”)。
查看答案和解析>>
科目:高中化學 來源:2012-2013學年北京市豐臺區第一次模擬理綜化學試卷試卷(解析版) 題型:實驗題
為驗證氧化性:Cl2>Fe3+>SO2,某小組用下圖所示裝置進行實驗(夾持儀器和A中的加熱裝置已略,氣密性已經檢驗完畢)
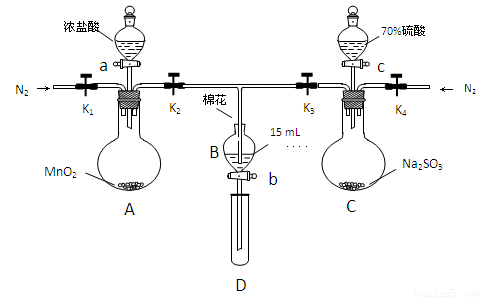
實驗過程:
Ⅰ.打開彈簧夾K1-K4,通入一段時間N2,再將T型導管插入B中,繼續通入N2,單后關閉K1、K2、K3 .
Ⅱ.打開活塞a,滴加一定量的濃鹽酸,給A加熱.
Ⅲ.當B中的溶液變黃時,停止加熱,夾緊彈簧夾K2.
Ⅳ.打開活塞b,使約2ml的溶液流入D試管中,檢驗其中的離子.
Ⅴ.打開彈簧夾K3、活塞c,加入70%的硫酸,一段時間后夾緊彈簧夾K3.
Ⅵ.更新試管D,重復過程Ⅵ,檢驗B溶液中的離子.
(1)過程Ⅰ的目的是___________________________
(2)棉花中浸潤的溶液為_______________________
(3)A中發生反應的化學方程式為_____________________________________________
(4)用70%的硫酸支取SO2,反應速率比用98%的硫酸塊,原因是___________________
(5)過程Ⅳ中檢驗B溶液中是否含有硫酸根的操作是______________________________
(6)甲、乙、丙三位同學分別完成了上述實驗,他們的檢測結果一定能夠證明氧化Cl2>Fe3+>SO2的是
|
|
過程Ⅳ B溶液中含有的離子 |
過程Ⅵ B溶液中含有的離子 |
|
甲 |
有Fe3+無Fe2+ |
有SO42- |
|
乙 |
既有Fe3+又有Fe2+ |
有SO42- |
|
丙 |
有Fe3+無Fe2+ |
有Fe2+ |
(7)進行實驗過程Ⅴ時,B中的溶液顏色由黃色變為紅棕色,停止通氣,放置一段時間后溶液顏色變為淺綠色。
查閱資料:Fe2+(aq)+SO32-(aq)
 FeSO3(s)
FeSO3(s)
提出假設:FeCl3和SO2的反應經歷了中間產物FeSO3,溶液的紅棕色是FeSO3(墨綠色)與FeCl3(黃色)的混合顏色。
某同學設計如下實驗,正式該假設的成立:

溶液E和F分別是___________、_______________
請用化學平衡原理解釋步驟3紅棕色溶液變為淺綠色的原因___________________________
查看答案和解析>>
科目:高中化學 來源:2012-2013學年天津市十二校高三第二次模擬聯考化學試卷(解析版) 題型:實驗題
為驗證氧化性Cl2 > Fe3+ > SO2,某小組用下圖所示裝置進行實驗(夾持儀器和A中加熱裝置已略,氣密性已檢驗)。
實驗過程:
Ⅰ.打開彈簧夾K1~K4,通入一段時間N2,再將T型導管插入B中, 繼續通入N2,然后關閉K1、K3、K4。
Ⅱ.打開活塞a,滴加一定量的濃鹽酸,加熱A。
Ⅲ.當B中溶液變黃時,停止加熱,夾緊K2。
Ⅳ.打開活塞b,使約2mL的溶液流入D試管中,并檢驗其中的離子。
Ⅴ.打開K3和活塞c,加入70%的硫酸,一段時間后夾緊K3。
Ⅵ.更新試管D,重復過程Ⅳ。
(1)過程Ⅰ的目的是 。
(2)棉花中浸潤的溶液為 。
(3)A中發生反應的化學方程式為 。
(4)能說明氧化性Fe3+ > SO2的離子方程式是 。
(5)過程Ⅵ,檢驗B溶液中是否含有SO42-的操作是 。
(6)甲、乙、丙三位同學分別完成了上述實驗,他們的檢測結果不能夠證明氧化性Cl2 > Fe3+ > SO2的是 (填“甲”“乙”“丙”),請用必要的文字說明理由 。
|
|
過程Ⅳ B溶液中含有的離子 |
過程Ⅵ B溶液中含有的離子 |
|
甲 |
有Fe3+無Fe2+ |
有 Fe2+ |
|
乙 |
既有Fe3+又有Fe2+ |
有SO42- |
|
丙 |
有Fe3+無Fe2+ |
有SO42- |
(7)進行實驗過程Ⅴ時,B中溶液顏色由黃色逐漸變為紅棕色,停止通氣,放置一段時間后溶液顏色變為淺綠色。
查閱資料: Fe2+(aq)+
SO32- (aq) 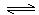 FeSO3(s)(墨綠色)提出假設:FeCl3與 SO2的反應經歷了中間產物FeSO3,溶液的紅棕色是FeSO3(墨綠色)與FeCl3(黃色)的混合色。
FeSO3(s)(墨綠色)提出假設:FeCl3與 SO2的反應經歷了中間產物FeSO3,溶液的紅棕色是FeSO3(墨綠色)與FeCl3(黃色)的混合色。
某同學設計如下實驗,證實該假設成立:

① 溶液E和F分別為 、 (寫化學式)。
②請用化學平衡原理解釋步驟3中紅棕色溶液顏色變為淺綠色的原因 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com