
 Y、z為同周期金屬元素,Y、Z的最高價氧化物對應水化物可以反應生成鹽和水.回答下列問題:
Y、z為同周期金屬元素,Y、Z的最高價氧化物對應水化物可以反應生成鹽和水.回答下列問題:分析 X、Y、Z三種常見短周期元素,由于X的原子結構示意圖可知a=2,故X為O元素;結合(1)Y2X2為淺黃色固體物質,可知Y為Na元素,Y、Z為同周期金屬元素,二者的最高價氧化物對應水化物可以反應生成鹽和水,為氫氧化鈉與氫氧化鋁反應,故Z為Al元素,據此進行解答.
解答 解:X、Y、Z三種常見短周期元素,由于X的原子結構示意圖可知a=2,故X為O元素,結合(1)Y2 X2為淺黃色固體物質,可知Y為Na元素,Y、Z為同周期金屬元素,二者的最高價氧化物對應水化物可以反應生成鹽和水,為氫氧化鈉與氫氧化鋁反應,故Z為Al元素,
(1)Na2O2由鈉離子與過氧根離子構成的離子化合物,其過氧根離子與鈉離子的個數比為1:2;過氧根離子與鈉離子之間形成離子鍵,過氧根離子中氧原子之間形成非極性鍵,
故答案為:1:2;離子鍵;非極性鍵;
(2)將單質Al的薄片在酒精燈上加熱至熔化,由于反應生成氧化鋁,氧化鋁的熔點比鋁高,氧化鋁膜兜住鋁箔融化成的小球不落下,
故答案為:融化成的小球不落下;氧化鋁的熔點比鋁高;
(3)氫氧化鈉與氫氧化鋁反應生成偏鋁酸鈉與水,反應離子方程式為:Al(OH)3+OH-=AlO2-+2H2O,
故答案為:Al(OH)3+OH-=AlO2-+2H2O.
點評 本題考查了位置、結構與性質關系的應用,題目難度中等,正確推斷各元素為解答關鍵,注意掌握原子結構與元素周期表、元素周期律的關系,試題培養了學生的分析能力及靈活應用能力.


 提分百分百檢測卷單元期末測試卷系列答案
提分百分百檢測卷單元期末測試卷系列答案 小學期末標準試卷系列答案
小學期末標準試卷系列答案科目:高中化學 來源: 題型:解答題

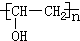 ;檢驗B常用的試劑為銀氨溶液或新制氫氧化銅懸濁液;
;檢驗B常用的試劑為銀氨溶液或新制氫氧化銅懸濁液;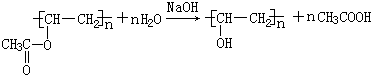 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水、二氧化硫和干冰都屬氧化物 | B. | H2SO4、HNO3和H2CO3都屬于酸 | ||
| C. | KNO3、CuSO4和NH4Cl都屬于鹽 | D. | 燒堿、純堿、熟石灰都屬于堿 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3COOH與C6H5COOH為同系物 | |
| B. | 戊烷比丙烷的沸點高 | |
| C. | 烷烴的化學性質與甲烷類似,通常較穩定 | |
| D. | 用燃燒法可鑒別甲烷和乙烯 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 以NaCl溶液或NaOH溶液為電解液時,正極反應都為:O2+2H2O+4e-═4OH- | |
| B. | 以NaOH溶液為電解液時,負極區域的現象:先生成白色沉淀后逐漸溶解 | |
| C. | 以NaOH溶液為電解液時,電池在工作過程中電解液的pH保持不變 | |
| D. | 電池工作時,電子通過外電路從正極流向負極 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 為防止水體富營養化.必須控制富含氮、磷污水的排放 | |
| B. | 在元素周期表的金屬和非金屬分界線附近尋找半導體材料 | |
| C. | 根據元索周期律,由HClO4可以類推出氟元素也存在最高價氧化物的水化物HFO4 | |
| D. | 汽車尾氣中產生NO的原因是空氣中的N2與O2在汽車汽缸內的高溫環境下發生反應產生的 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2.4g Mg與N2完全反應,轉移電子數都是0.3NA | |
| B. | 1mol白磷分子中含有P-P鍵數為1.5NA | |
| C. | 1.7gH2O2中含有的電子數為0.9NA | |
| D. | 在18g 18O2中含有2NA個氧原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
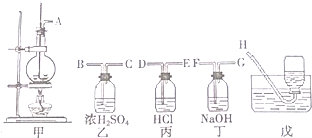
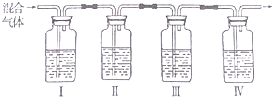
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ${\;}_{77}^{192}$Ir核外含有115個電子 | B. | Ir為非金屬元素 | ||
| C. | ${\;}_{77}^{192}$Ir的中子數是115 | D. | ${\;}_{77}^{192}$Ir的質量數是77 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com