
【題目】Ⅰ.2019年3月1日晚,一艘外籍冷藏運輸船在山東威海榮成市榮喜港裝卸過程中,貨艙發生液氨泄漏事故,造成5名中國籍雇員死亡。試回答下列問題:
(1)液氨能做制冷劑的原因是_________
(2)實驗室制取氨氣的化學方程式為________;
Ⅱ.液氨是否泄漏可以用氯氣進行檢驗,某學生利用以下裝置探究氯氣與氨之間的反應。其中A、F分別為氨氣和氯氣的發生裝置,C為純凈干燥的氯氣與氨反應的裝置。
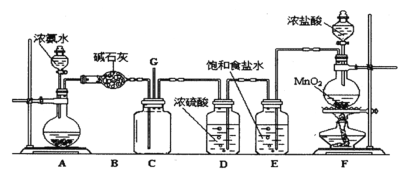
請回答下列問題:
(1)裝置B中儀器的名稱是_________;裝置E的作用是 ____________。
(2)D中體現了濃硫酸的___________性。
(3)裝置F中發生反應的化學方程式:_______,若生成標況下的氯氣2.24L,則被氧化的鹽酸的物質的量為__________。
(4)裝置C內出現濃厚的白煙并在容器內壁凝結,另一生成物是空氣的主要成分之一,試寫出檢驗液氨泄漏的化學方程式____________。
【答案】液氨氣化時要吸收大量的熱使溫度降低 2NH4Cl+Ca(OH)2![]() CaCl2+ 2NH3↑+2H2O 干燥管 除去氯氣中的氯化氫 吸水性 MnO2+4HCl(濃)
CaCl2+ 2NH3↑+2H2O 干燥管 除去氯氣中的氯化氫 吸水性 MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O 0.2 mol 3Cl2+8NH3 = N2+6NH4Cl
MnCl2+Cl2↑+2H2O 0.2 mol 3Cl2+8NH3 = N2+6NH4Cl
【解析】
Ⅰ.(1)液氨氣化時要吸收大量的熱使溫度降低;
(2)實驗室用NH4Cl和Ca(OH)2制取氨氣;
Ⅱ.A、F分別為氨氣和氯氣的發生裝置,裝置E的作用是除去氯氣中的氯化氫,D用于干燥氯氣,B中堿石灰用于干燥氨氣,C為純凈干燥的氯氣與氨反應的裝置,在C中氨氣中的氮被氯氣氧化生成氮氣,氯氣被還原成HCl,遇過量的氨氣生成固體NH4Cl。
Ⅰ.(1)液氨能做制冷劑的原因是液氨氣化時要吸收大量的熱使溫度降低,故答案為:液氨氣化時要吸收大量的熱使溫度降低;
(2)實驗室用NH4Cl和Ca(OH)2制取氨氣,化學方程式為2NH4Cl+Ca(OH)2![]() CaCl2+ 2NH3↑+2H2O;故答案為:2NH4Cl+Ca(OH)2
CaCl2+ 2NH3↑+2H2O;故答案為:2NH4Cl+Ca(OH)2![]() CaCl2+ 2NH3↑+2H2O;
CaCl2+ 2NH3↑+2H2O;
Ⅱ.(1)裝置B中堿石灰用于干燥氨氣,裝置B中儀器的名稱是干燥管;濃鹽酸具有揮發性,裝置E的作用是除去氯氣中的氯化氫。故答案為:干燥管;除去氯氣中的氯化氫;
(2)D用于干燥氯氣,D中體現了濃硫酸的吸水性。故答案為:吸水性;
(3)裝置F中發生反應是:MnO2和HCl(濃)加熱后產生氯氣,化學方程式:MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O,由方程式每生成1molCl2,有2molHCl被氧化,若生成標況下的氯氣2.24L,則被氧化的鹽酸的物質的量為0.2mol。故答案為:MnO2+4HCl(濃)
MnCl2+Cl2↑+2H2O,由方程式每生成1molCl2,有2molHCl被氧化,若生成標況下的氯氣2.24L,則被氧化的鹽酸的物質的量為0.2mol。故答案為:MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O;0.2mol;
MnCl2+Cl2↑+2H2O;0.2mol;
(4)氯氣和氨氣的反應中,氯氣被還原成HCl,遇過量的氨氣生成固體NH4Cl,氨氣中的氮被氯氣氧化生成氮氣。裝置C內出現濃厚的白煙并在容器內壁凝結,說明生成物中有氯化銨固體,另一生成物是空氣的主要成分之一,是氨氣中的氮被氯氣氧化生成的氮氣,檢驗液氨泄漏的化學方程式3Cl2+8NH3 = N2+6NH4Cl。故答案為:3Cl2+8NH3 = N2+6NH4Cl。


科目:高中化學 來源: 題型:
【題目】SiCl4在室溫下為無色液體,易揮發,有強烈的刺激性。把SiCl4先轉化為SiHCl3,再經氫氣還原生成高純硅。一定條件下,在20L恒容密閉容器中發生SiCl4轉化為SiHCl3的反應:3SiCl4(g)+2H2(g)+Si(s)SiHCl3(g),△H=QkJmol-1,2min后達到平衡,H2與SiHCl3的物質的量濃度分別為0.1mol/L和0.2mol/L。
(1)從反應開始到平衡,v(SiCl4)=_______
(2)該反應的平衡常數表達式為K=_______,溫度升高,K值增大,則Q__0(填“>”、“<”或“=”)。
(3)若平衡后再向容器中充入與起始時等量的SiCl4和H2(假設Si足量),當反應再次達到平衡時,與原平衡相比較,H2的體積分數將____(填“增大”、“減小”或“不變”)。
(4)原容器中,通入H2的體積(標準狀況下)為_________
(5)平衡后,將容器的體積縮為10L,再次達到平衡時,H2的物質的量濃度范圍為__________
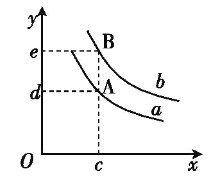
(6)圖中x軸表示溫度,y軸表示平衡混合氣中H2的體積分數,a、b表示不同的壓強,則壓強a____b(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物A可以通過不同化學反應分別制得B、C和D三種物質,結構簡式如圖所示:
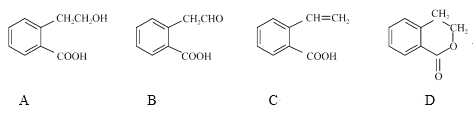
(1)A的分子式是____;B中的含氧官能團名稱是____。
(2)A→B的反應類型是___;A~D中互為同分異構體的是___(填代號)。
(3)D在酸性條件下水解的化學方程式是____。
(4)B與足量新制Cu(OH)2懸濁液反應的化學方程式是___________。
(5)符合下列條件的A的同分異構體有____種。
①官能團與A完全相同且與苯環直接相連;②苯環上有三個取代基。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫、氮、氯其化合物在生產生活中應用廣泛。請回答:
(1)將SO2通入品紅溶液中,現象為品紅溶液________,加熱后溶液顏色________。
(2)已知反應:SO2+Cl2+2H2O ═ 2HCl+H2SO4,該反應中的氧化產物是__________。
(3)木炭與濃硫酸共熱的化學反應方程式為:C+2H2SO4(濃)![]() CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,則轉移電子的物質的量是_________mol。
CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,則轉移電子的物質的量是_________mol。
(4)汽車尾氣常含有NO、NO2、CO等,會污染空氣。在汽車尾氣排放管處安裝一個催化轉化器,可使尾氣中有害氣體CO和NO反應轉化為兩種無毒氣體,該反應的化學方程式___________。
(5)“84”消毒液(主要成分是NaClO)和潔廁劑(主要成分是濃鹽酸)不能混用,原因是___________(用離子方程式表示)。利用氯堿工業的產物可以生產“84”消毒液,寫出有關反應的化學方程式:____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z 是中學化學中常見的三種物質,下表各組物質之間通過一步反應不能實現右圖所示轉化關系的是
X | Y | Z | 箭頭上所標數字的反應條件 | ||
A. | NO | NO2 | HNO3 | ①常溫遇氧氣 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下列各組離子在指定溶液中能大量共存的是
A. 無色透明的溶液中:Fe3+、Mg2+、SCN-、Cl-
B. c(H+)/c(OH﹣) =1×10-12的溶液中:K+、Na+、![]() 、
、![]()
C. c(Fe2+)=1 molL-1的溶液中:K+、![]() 、
、![]() 、
、![]()
D. 能使甲基橙變紅的溶液中:Na+、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鹵塊的主要成分是MgCl2,還含有少量Fe2+、Fe3+和Mn2+等雜質離子。現以鹵塊為原料按如下流程進行生產,以制備金屬鎂。

本流程操作條件下,生成氫氧化物沉淀的pH如下表:
物質 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
開始沉淀 | 2.7 | 7.6 | 8.3 | 10.0 |
沉淀完全 | 3.7 | 9.6 | 9.8 | 11.1 |
*Fe2+氧氧化物呈絮狀,不易從溶液中除去,常將它氧化為Fe3+后生成Fe(OH)3沉淀除去。 請回答以下問題:
(1)步驟①中,為了加快酸溶速率,除了適當增加稀鹽酸的濃度外,還可以采取的措施有 __________________________ (任寫一條)。
(2)步驟②中NaClO的電子式為__________,加入NaClO溶液的目的是_________________________
(用離子方程式解釋)。
(3)常溫時,Mg(OH)2的Ksp=1.8×10-11。當溶液pH=10.0時,溶液中的c(Mg2+)=___________。
(4)若將步驟⑤中“稀鹽酸”改為“加水、煮沸”的方式可以得到另一種沉淀物和一種無色無味的氣體,請寫出該反應的化學方程式__________________________________________。
(5)步驟⑥中涉及的操作是_____________________________,且⑥⑦操作均需在HCl氣流中進行,其原因是_______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,表中的每個字母表示一種短周期元素,回答下列問題:
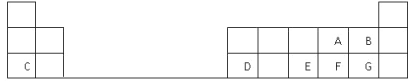
(1)畫出C的原子結構示意圖__________。
(2)D在元素周期表中的位置是第三周期第________族。
(3)A、B、E、F、G五種元素所形成的氣態氫化物最不穩定的是__________(填化學式)。
(4)E、F元素的最高價氧化物對應水化物的酸性較強的是____________(填化學式)。
(5)寫出C和F形成的化合物的電子式______________________。
(6)A、C、D的簡單離子半徑大小關系是__________________ (用離子符號表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com