
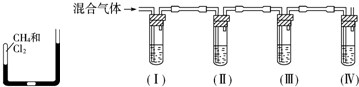
分析 (1)NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl由于碳酸氫鈉的溶解度相對較小,所以在溶液中首先結晶析出;
(2)①(Ⅰ)用飽和碳酸氫鈉溶液吸收揮發過來的 HCl;
(Ⅱ)丁裝置中稀硫酸的作用是防止未反應的 NH3 產生環境污染;
②(Ⅰ)由于 NH3的溶解度比CO2 的溶解度大很多倍,先通 NH3會得到更多的 NaHCO3,從而提高生產效率;
(Ⅱ)由于底部具有放大了的多孔球泡,增大了氣體與溶液接觸面積,從而提高 CO2吸收率.
解答 解:(1)堿性條件下,增加二氧化碳的溶解度,首先通入氨氣,與二氧化碳與氯化鈉反應生成溶解度極小的碳酸氫鈉,故選:c;
(2)①(Ⅰ)用飽和碳酸氫鈉溶液吸收揮發過來的 HCl,故答案為:飽和碳酸氫鈉溶液;
(Ⅱ)丁裝置中稀硫酸的作用是防止未反應的 NH3,故答案為:吸收未反應的 NH3;
②(Ⅰ)氨氣極易溶于水,而且在堿性條件下,二氧化碳的溶解度很大,生成大量的碳酸氫鈉固體,所以首先通入氨氣,然后通入二氧化碳,故答案為:NH3;CO2;(Ⅱ)由于底部具有放大了的多孔球泡,增大了氣體與溶液接觸面積,從而提高 CO2吸收率,故答案為:增大氣體與溶液接觸面積,提高 CO2 吸收率.
點評 本題主要考查“侯氏制堿法”的反應原理,題目較為綜合,難度較大,解答須明晰制堿的原理.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 火炬燃料丙烷充分燃燒后只生成二氧化碳和水 | |
| B. | 撐桿跳高運動員使用的碳纖維撐桿屬于有機高分子材料 | |
| C. | 泳池中加入的適量漂白粉可起到殺菌消毒作用 | |
| D. | 舉重和體操運動員手上涂抹的碳酸鎂白色粉末可吸水防滑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 平衡后移走部分Z,平衡正向移動 | |
| B. | 若正反應為放熱反應,則X一定為氣態 | |
| C. | 若X為非氣態,則正反應為放熱反應 | |
| D. | 若X為氣態,再向容器中充入amolX,達到平衡后,X的體積分數增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知三個反應如下:
已知三個反應如下:| T/℃ | 700℃ | 800℃ |
| K1 | 2.38 | 2.56 |
| K2 | 0.80 |
| 反應時間/min | 0 | 2 | 4 | 6 |
| N(CO)/mol | 1.20 | 0.90 | 0.80 | |
| N(H2O)/mol | 0.60 | 0.20 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 20 mol、25% | B. | 20 mol、75% | C. | 40 mol、30% | D. | 10mol、50% |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 400mL | B. | 500mL | C. | 450mL | D. | 無法確定 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com