
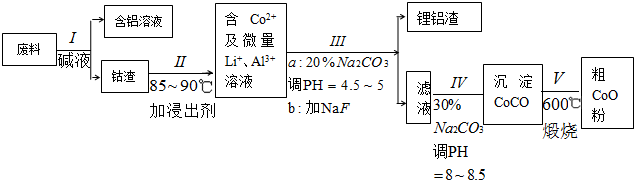
分析 操作Ⅰ利用了鋁能溶解在氫氧化鈉溶液的性質,將鋁從廢料中分離出來,過濾后得到含Co2O3•CoO的鈷渣,再用酸溶解過濾后得到含Co3+及Al3+、Li+的濾液,通過調整溶液的pH得到Al(OH)3和LiF沉淀,再過濾得到含Co3+的濾液,再滴加Na2CO3溶液得到CoCO3沉淀,經過濾、洗滌沉淀,最后將CoCO3進行加熱分解可得CoO粉末,
(1)Al和NaOH溶液發生氧化還原反應生成偏鋁酸鈉和氫氣;
(2)Co2O3•CoO在酸性條件下和硫代硫酸鈉反應生成鈷離子、硫酸根離子和水;
Co2O3•CoO具有氧化性,HCl具有還原性,二者發生氧化還原反應;
(3)Al3+和CO32-發生雙水解反應生成Al(OH)3和CO2;Co2+和CO32-反應生成CoCO3沉淀;
(4)任何電解質溶液中都存在電荷守恒和物料守恒,根據電荷守恒和物料守恒判斷;
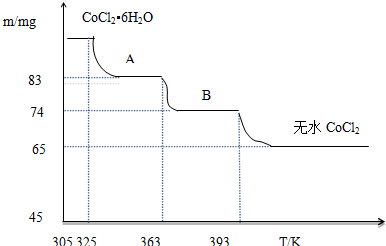
(5)根據關系式CoCl2•6H2O~CoCl2求出CoCl2•6H2O的質量,然后再根據差量法求出B物質的化學式.
解答 解:操作Ⅰ利用了鋁能溶解在氫氧化鈉溶液的性質,將鋁從廢料中分離出來,過濾后得到含Co2O3•CoO的鈷渣,再用酸溶解過濾后得到含Co3+及Al3+、Li+的濾液,通過調整溶液的pH得到Al(OH)3和LiF沉淀,再過濾得到含Co3+的濾液,再滴加Na2CO3溶液得到CoCO3沉淀,經過濾、洗滌沉淀,最后將CoCO3進行加熱分解可得CoO粉末,
(1)Al和NaOH溶液發生氧化還原反應生成偏鋁酸鈉和氫氣,反應方程式為2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案為:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)Co2O3•CoO在酸性條件下和硫代硫酸鈉反應生成鈷離子、硫酸根離子和水,離子方程式為4Co2O3•CoO+S2O32-+22H+=12Co2++2SO42-+11H2O;
Co2O3•CoO具有氧化性,HCl具有還原性,二者發生氧化還原反應生成氯氣,氯氣有毒,污染環境,所以不能用鹽酸;
故答案為:4Co2O3•CoO+S2O32-+22H+=12Co2++2SO42-+11H2O;Co2O3•CoO可氧化鹽酸產生Cl2,污染環境;
(3)Al3+和CO32-發生雙水解反應生成Al(OH)3和CO2;Co2+和CO32-反應生成CoCO3沉淀,離子方程式分別為2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑、Co2++CO32-=CoCO3↓,故答案為:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;Co2++CO32-=CoCO3↓;
(4)A.碳酸根離子水解、碳酸氫根離子水解程度大于電離程度導致溶液中堿性,所以c(OH-)>c(H+),碳酸根離子、碳酸氫根離子水解程度都較小,所以溶液中存在c(CO32-)>c(HCO3-)>c(OH-)>c(H+),故A正確;
B.溶液中存在電荷守恒c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),存在物料守恒3c(Na+)=5c(CO32-)+5c(HCO3-)+5c(H2CO3),則3c(OH-)=3c(H+)+2c(HCO3-)+5c(H2CO3)+2c(CO32-),故B錯誤;
C.根據物料守恒可得:3c(Na+)=5c(CO32-)+5c(HCO3-)+5c(H2CO3),所以3c(Na+)>5c(CO32-)+5c(HCO3-),故C錯誤;
D.溶液中存在電荷守恒c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故D正確;
故答案為:AD;
(5)CoCl2•6H2O~CoCl2
238 130
m 65mg
$\frac{238}{m}$,解得:m=119mg
B物質的化學式為CoCl2•nH2O,則有:
CoCl2•6H2O~CoCl2•nH2O△m
238 18(6-n)
119mg 119mg-74mg
$\frac{238}{119mg}$=$\frac{18(6-n)}{(119-74)mg}$,解得:n=1,
所以B物質的化學式為:CoCl2•H2O,
故答案為:CoCl2•H2O.
點評 本題考查物質分離和提純、離子濃度大小比較、化學方程式的有關計算等知識點,為高頻考點,明確物質性質、各物質之間的關系、常見物質分離提純方法等知識點是解本題關鍵,知道流程圖中發生的反應及基本操作方法,難點是B物質化學式的確定.


 鷹派教輔銜接教材河北教育出版社系列答案
鷹派教輔銜接教材河北教育出版社系列答案 初中暑期銜接系列答案
初中暑期銜接系列答案科目:高中化學 來源: 題型:選擇題
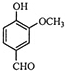
| A. | A的分子式是C8H10O3 | B. | A分子中含有酯基 | ||
| C. | A只能發生取代反應 | D. | A能與Na反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | NaCl、HCl、NaAlO2、NaHCO3 | B. | NaSO4、KNO3、(NH4)2SO4、MgCl2 | ||
| C. | FeCl3、NaOH、AlCl3、HNO3 | D. | AgNO3、NaCl、NaSO4、NaI |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 甲裝置:可用來證明硫的非金屬性比硅強 | |
| B. | 乙裝置:用鹽酸標準液測氫氧化鈉溶液濃度 | |
| C. | 丙裝置:配制一定物質的量濃度的氫氧化鈉溶液 | |
| D. | 丁裝置:可在瓶中先裝滿水,氣體由②口入,收集NO氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K2Cr2O7的溶液中存在的平衡體系:Cr2O72-+H2O?2CrO42-+2H+ | |
| B. | 硫代硫酸鈉與硫酸的離子方程式:S2O32-+2H+═SO2↑+S↓+H2O | |
| C. | KI溶液中滴加稀硫酸、雙氧水:2H++2I-+H2O2═I2+2H2O | |
| D. | 用H2S沉淀硫酸銅中銅離子:S2-+Cu2+═CuS↓ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com