
 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:閱讀理解
(12分)合成氨生產技術的創立開辟了人工固氮的途徑,對化學工業技術也產生了重大影響。合成氨反應的化學方程式為:N2(g)+3H2(g)![]() 3NH3(g)△H=-92.2kJ/mol。合成氨工業中原料氣N2可從空氣中分離得到,H2可用碳在高溫下與水蒸氣反應制得。我國合成氨工業目前的生產條件為:催化劑-鐵觸媒,溫度-400~500℃,壓強-30~50MPa。回答下列問題:
3NH3(g)△H=-92.2kJ/mol。合成氨工業中原料氣N2可從空氣中分離得到,H2可用碳在高溫下與水蒸氣反應制得。我國合成氨工業目前的生產條件為:催化劑-鐵觸媒,溫度-400~500℃,壓強-30~50MPa。回答下列問題:
(1)將水蒸氣通過紅熱的炭即產生水煤氣:
C(s) + H2O(g) H2(g) +CO(g) △H = +131.3 kJ ,△S = +133.7 J/K
該反應在低溫下能否自發 (填:能或否)。
(2)合成氨工業中原料氣壓縮到30~50MPa的原因是 。從平衡移動原理分析,低溫有利于原料氣的轉化,實際生產中采用400~500℃的高溫,原因之一是考慮到催化劑的催化活性,原因之二是 。
(3)已知在400℃時,N2 (g)+ 3H2(g) 2NH3(g) 的K=0.5。
①在400℃時, 2NH3(g)N2 (g)+ 3H2(g)的K= (填數值)。
②400℃時,在0.5L的反應容器中進行合成氨反應,一段時間后,測得N2、H2、NH3的物質的量分別為2mol、1mol、2mol,則此時反應V(N2)正 V(N2)逆(填:>、<、=、不能確定)。
③500℃、50MPa時,在容積為2L的容器中加入1 mol N2、3 mol H2,反應達平衡后測得平衡常數為K,此時N2的轉化率為x。則K和x的關系滿足K= 。
④在三個相同容器中各充入1 molN2和3molH2,在某一不同條件下反應并達到平衡,氨的體積分數隨時間變化曲線如下圖。下列說法正確的是 (填序號)。
A.圖Ⅰ可能是不同壓強對反應的影響,且P2>P1
B.圖Ⅱ可能是不同壓強對反應的影響,且P1>P2
C.圖Ⅲ可能是不同溫度對反應的影響,且T1>T2
D.圖Ⅱ可能是同溫同壓下,催化劑性能:1>2
查看答案和解析>>
科目:高中化學 來源:2010年浙江省杭州地區七校聯考高二第二學期期中化學試卷 題型:填空題
(12分)合成氨生產技術的創立開辟了人工固氮的途徑,對化學工業技術也產生了重大影響。合成氨反應的化學方程式為:N2(g)+3H2(g) 3NH3(g) △H=-92.2kJ/mol。合成氨工業中原料氣N2可從空氣中分離得到,H2可用碳在高溫下與水蒸氣反應制得。我國合成氨工業目前的生產條件為:催化劑-鐵觸媒,溫度-400~500℃,壓強-30~50MPa。回答下列問題:
3NH3(g) △H=-92.2kJ/mol。合成氨工業中原料氣N2可從空氣中分離得到,H2可用碳在高溫下與水蒸氣反應制得。我國合成氨工業目前的生產條件為:催化劑-鐵觸媒,溫度-400~500℃,壓強-30~50MPa。回答下列問題:
(1)將水蒸氣通過紅熱的炭即產生水煤氣:
C(s) + H2O(g)  H2(g) + CO(g) △H =" +131.3" kJ ,△S =" +133.7" J/K
H2(g) + CO(g) △H =" +131.3" kJ ,△S =" +133.7" J/K
該反應在低溫下能否自發 (填:能或否)。
(2)合成氨工業中原料氣壓縮到30~50MPa的原因是 。從平衡移動原理分析,低溫有利于原料氣的轉化,實際生產中采用400~500℃的高溫,原因之一是考慮到催化劑的催化活性,原因之二是 。
(3)已知在400℃時,N2 (g)+ 3H2(g) 2NH3(g) 的K=0.5。
2NH3(g) 的K=0.5。
①在400℃時, 2NH3(g) N2 (g)+ 3H2(g)的K= (填數值)。
N2 (g)+ 3H2(g)的K= (填數值)。
②400℃時,在0.5L的反應容器中進行合成氨反應,一段時間后,測得N2、H2、NH3的物質的量分別為2mol、1mol、2mol,則此時反應V(N2)正 V(N2)逆(填:>、<、=、不能確定)。
③500℃、50MPa時,在容積為2L的容器中加入1 mol N2、3mol H2,反應達平衡后測得平衡常數為K,此時N2的轉化率為x。則K和x的關系滿足K= 。
④在三個相同容器中各充入1 molN2和3molH2,在某一不同條件下反應并達到平衡,氨的體積分數隨時間變化曲線如下圖。下列說法正確的是 (填序號)。
| A.圖Ⅰ可能是不同壓強對反應的影響,且P2>P1 |
| B.圖Ⅱ可能是不同壓強對反應的影響,且P1>P2 |
| C.圖Ⅲ可能是不同溫度對反應的影響,且T1>T2 |
| D.圖Ⅱ可能是同溫同壓下,催化劑性能:1>2 |
查看答案和解析>>
科目:高中化學 來源:2010年浙江省杭州地區七校聯考高二第二學期期中化學試卷 題型:填空題
(12分)合成氨生產技術的創立開辟了人工固氮的途徑,對化學工業技術也產生了重大影響。合成氨反應的化學方程式為:N2(g)+3H2(g) 3NH3(g)
△H=-92.2kJ/mol。合成氨工業中原料氣N2可從空氣中分離得到,H2可用碳在高溫下與水蒸氣反應制得。我國合成氨工業目前的生產條件為:催化劑-鐵觸媒,溫度-400~500℃,壓強-30~50MPa。回答下列問題:
3NH3(g)
△H=-92.2kJ/mol。合成氨工業中原料氣N2可從空氣中分離得到,H2可用碳在高溫下與水蒸氣反應制得。我國合成氨工業目前的生產條件為:催化劑-鐵觸媒,溫度-400~500℃,壓強-30~50MPa。回答下列問題:
(1)將水蒸氣通過紅熱的炭即產生水煤氣:
C(s) + H2O(g)  H2(g) +
CO(g) △H = +131.3 kJ ,△S = +133.7 J/K
H2(g) +
CO(g) △H = +131.3 kJ ,△S = +133.7 J/K
該反應在低溫下能否自發 (填:能或否)。
(2)合成氨工業中原料氣壓縮到30~50MPa的原因是 。從平衡移動原理分析,低溫有利于原料氣的轉化,實際生產中采用400~500℃的高溫,原因之一是考慮到催化劑的催化活性,原因之二是 。
(3)已知在400℃時,N2 (g)+ 3H2(g)  2NH3(g) 的K=0.5。
2NH3(g) 的K=0.5。
①在400℃時, 2NH3(g) N2 (g)+ 3H2(g)的K=
(填數值)。
N2 (g)+ 3H2(g)的K=
(填數值)。
②400℃時,在0.5L的反應容器中進行合成氨反應,一段時間后,測得N2、H2、NH3的物質的量分別為2mol、1mol、2mol,則此時反應V(N2)正 V(N2)逆(填:>、<、=、不能確定)。
③500℃、50MPa時,在容積為2L的容器中加入1 mol N2、3 mol H2,反應達平衡后測得平衡常數為K,此時N2的轉化率為x。則K和x的關系滿足K= 。
④在三個相同容器中各充入1 molN2和3molH2,在某一不同條件下反應并達到平衡,氨的體積分數隨時間變化曲線如下圖。下列說法正確的是 (填序號)。

A.圖Ⅰ可能是不同壓強對反應的影響,且P2>P1
B.圖Ⅱ可能是不同壓強對反應的影響,且P1>P2
C.圖Ⅲ可能是不同溫度對反應的影響,且T1>T2
D.圖Ⅱ可能是同溫同壓下,催化劑性能:1>2
查看答案和解析>>
科目:高中化學 來源: 題型:
((08揭陽市一模)(10分)合成氨生產技術的創立開辟了人工固氮的途徑,對化學工業技術也產生了重大影響。合成氨反應的化學方程式為:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.2kJ/mol。合成氨工業中原料氣N2可從空氣中分離得到,H2可用甲烷在高溫下與水蒸氣反應制得。我國合成氨工業目前的生產條件為:
2NH3(g) △H=-92.2kJ/mol。合成氨工業中原料氣N2可從空氣中分離得到,H2可用甲烷在高溫下與水蒸氣反應制得。我國合成氨工業目前的生產條件為:
催化劑-鐵觸媒,溫度-400~500℃,壓強-30~50MPa。
回答下列問題:
⑴ 合成氨工業中原料氣壓縮到30~50MPa的原因是 。從平衡移動原理分析,低溫有利于原料氣的轉化,實際生產中采用400~500℃的高溫,原因之一是考慮到催化劑的催化活性,原因之二是 。
⑵ 500℃、50MPa時,在容積為VL的容器中加入n mol N2、3n mol H2,反應達平衡后測得平衡常數為K,此時N2的轉化率為x。則K和x的關系滿足K= 。
⑶有人設想尋求合適的催化劑和電極材料,以N2、H2為電極反應物,以HCl-NH4Cl為電解質溶液制取新型燃料電池。請寫出該電池的正極反應式 。
⑷已知H2(g)、 CO(g) 、CH4(g)三種物質的燃燒熱分別是-285.8 kJ?mol-1、 -283.0 kJ?mol-1、
-890.3 kJ?mol-1,1mol H2O(g)轉變為1mol H2O(l)時放出44.0 kJ熱量。甲烷在高溫下與水蒸氣反應的化學方程式為:CH4(g)+H2O(g)=CO(g)+3H2(g)。那么該反應的反應熱△H 0 (填>、= 或 <)。
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
合成氨生產技術的創立開辟了人工固氮的途徑,對化學工業技術也產生了重大影響。合成氨反應的化學方程式為:N2(g)+3H2(g)![]() 3NH3(g) △H=-92.2kJ/mol。合成氨工業中原料氣N2可從空氣中分離得到,H2可用碳在高溫下與水蒸氣反應制得。我國合成氨工業目前的生產條件為:催化劑-鐵觸媒,溫度-400~500℃,壓強-30~50MPa。回答下列問題:
3NH3(g) △H=-92.2kJ/mol。合成氨工業中原料氣N2可從空氣中分離得到,H2可用碳在高溫下與水蒸氣反應制得。我國合成氨工業目前的生產條件為:催化劑-鐵觸媒,溫度-400~500℃,壓強-30~50MPa。回答下列問題:
(1)將水蒸氣通過紅熱的炭即產生水煤氣:
C(s) + H2O(g) ![]() H2(g) + CO(g) △H = +131.3 kJ ,△S = +133.7 J/K
H2(g) + CO(g) △H = +131.3 kJ ,△S = +133.7 J/K
該反應在低溫下能否自發 (填:能或否)。
(2)合成氨工業中原料氣壓縮到30~50MPa的原因是 。從平衡移動原理分析,低溫有利于原料氣的轉化,實際生產中采用400~500℃的高溫,原因之一是考慮到催化劑的催化活性,原因之二是 。
(3)已知在400℃時,N2 (g)+ 3H2(g) ![]() 2NH3(g) 的K=0.5。
2NH3(g) 的K=0.5。
①在400℃時, 2NH3(g)![]() N2 (g)+ 3H2(g)的K= (填數值)。
N2 (g)+ 3H2(g)的K= (填數值)。
②400℃時,在0.5L的反應容器中進行合成氨反應,一段時間后,測得N2、H2、NH3的物質的量分別為2mol、1mol、2mol,則此時反應V(N2)正 V(N2)逆(填:>、<、=、不能確定)。
③500℃、50MPa時,在容積為2L的容器中加入1 mol N2、3 mol H2,反應達平衡后測得平衡常數為K,此時N2的轉化率為x。則K和x的關系滿足K= 。
④在三個相同容器中各充入1 molN2和3molH2,在某一不同條件下反應并達到平衡,氨的體積分數隨時間變化曲線如下圖。下列說法正確的是 (填序號)。
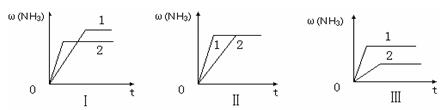
A.圖Ⅰ可能是不同壓強對反應的影響,且P2>P1
B.圖Ⅱ可能是不同壓強對反應的影響,且P1>P2
C.圖Ⅲ可能是不同溫度對反應的影響,且T1>T2
D.圖Ⅱ可能是同溫同壓下,催化劑性能:1>2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com