
分析 (1)根據外界條件對平衡的影響來確定平衡移動方向,從而確定溶液顏色變化;
(2)根據判斷平衡狀態的方法:V正=V逆,或各組分的濃度保持不變則說明已達平衡,也可根據化學平衡狀態的特征:逆、定、動、變、等來回答判斷;
(3)在氧化還原反應中,化合價升高值=化合價降低值=轉移電子數來計算;
(4)根據Ksp=c(Cr3+)•c3(OH-)來計算氫氧根離子離子的濃度,并計算氫離子濃度和pH的大小;Cr(OH)3是難溶電解質,在溶液中存在沉淀溶解平衡;
(5)陽極是活性電極時,陽極本身失電子,生成陽離子,Cr2O72-與亞鐵離子發生氧化還原反應;
(6)溶液PH升高的原因是溶液中氫離子濃度減少,即氫離子在陰極得電子,PH升高,氫氧根離子濃度增大,離子濃度冪的乘積大于溶度積,所以金屬陽離子會生成氫氧化物沉淀.
解答 解:(1)pH=12時溶液呈堿性,2CrO42- (黃色)+2H+?Cr2O72-(橙色)+H2O向逆向移動,溶液呈黃色,故答案為:黃;
(2)對于平衡:2CrO42-(黃色)+2H+?Cr2O72-(橙色)+H2O,
a.Cr2O72-和CrO42-的濃度相同,不一定平衡,故a錯誤;
b.2υ(Cr2O72-)=υ(CrO42-)不能證明正逆速率相等,所以不是平衡狀態,故b錯誤;
c.溶液的顏色不變,即有色離子濃度不會再不變,達到了化學平衡狀態,故c正確;
故答案為:ab;
(3)還原0.1mol Cr2O72-離子,鉻元素化合價從+6價降低到+3價,一共得到電子0.6mol,亞鐵離子被氧化為+3價,應該得到0.6mol電子,所以還原0.1mol Cr2O72-離子,需要0.6mol的FeSO4•7H2O,
故答案為:0.6;
(4)Ksp=c(Cr3+)•c3(OH-)=10-32,若將溶液的pH調至5,c(H+)=10-5mol/L,c(OH-)=10-9mol/L,c(Cr3+)=$\frac{1{0}^{-32}}{(1{0}^{-9})^{3}}$=mol/L=10-5mol/L,
故答案為:10-5;
(5)在電解法除鉻中,鐵作陽極,陽極反應為Fe-2e-═Fe2+,以提供還原劑Fe2+,與Cr2O72-發生氧化還原反應,離子方程式為Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案為:提供還原劑Fe2+;Fe-2e-═Fe2+;Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(6)在陰極附近溶液pH升高的原因是水電離產生的H+放電生成H2:2H++2e-═H2↑;同時大量產生了OH-,所以溶液中的Fe3+也將轉化為Fe(OH)3沉淀;
故答案為:2H++2e-═H2↑;Fe(OH)3.
點評 本題主要考查了鉻及其化合物的性質、氧化還原反應、沉淀溶解平衡和電化學知識等內容,為高頻考點,側重于學生的分析、實驗和計算能力的考查,難度中等,抓住題目信息是解題的關鍵,注意把握氧化還原反應原理以及溶度積在計算中的應用.


 高中必刷題系列答案
高中必刷題系列答案科目:高中化學 來源: 題型:解答題
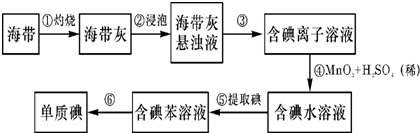
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ/mol | ||
| C. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 能使pH試紙呈紅色的溶液:Na+、NH4+、I-、NO3- | |
| B. | 常溫下pH=12的溶液:Na+、K+、SiO32-、NO3- | |
| C. | c(Fe3+)=0.1mol•L-1的溶液:H+、Al3+、I-、SCN- | |
| D. | 加入鋁粉生成H2的溶液:K+、Mg2+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | AgNO3溶液中加入過量的氨水:Ag++NH3•H2O=AgOH↓+NH4+ | |
| B. | 銨明礬[NH4Al(SO4)2•12H2O]溶液中加入過量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O | |
| C. | H2O2溶液中滴加酸性KMnO4溶液:2 MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O | |
| D. | 尼泊金酸(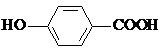 )與碳酸氫鈉溶液反應: )與碳酸氫鈉溶液反應: |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

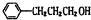 $?_{△}^{濃硫酸}$
$?_{△}^{濃硫酸}$ +H2O;該反應的反應類型為酯化反應或取代反應
+H2O;該反應的反應類型為酯化反應或取代反應 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
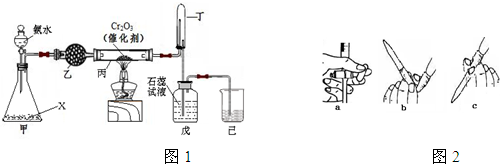
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
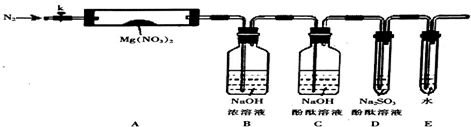
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Si用于制造光導纖維 | |
| B. | 過氧化鈉可用作潛艇供氧劑 | |
| C. | 水玻璃浸泡過的木材既能防腐又能耐火 | |
| D. | 常溫下,鐵槽、鋁槽可存放冷的濃硝酸、濃硫酸 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com