C
分析:方法一:將混合氣體通入含bmolNaOH的熱溶液中,氣體恰好被完全吸收,NaOH無剩余,測得反應后溶液中含Cl
-、ClO
-、ClO
-3,根據電荷守恒可知,溶液中n(Na
+)=n(Cl
-)+n(ClO
-)+n(ClO
-3),根據氯元素守恒,計算aLH
2和Cl
2的混合氣體中氯氣的物質的量,aLH
2和Cl
2的混合氣體總的物質的量減去氯氣的物質的量即為氫氣的物質的量.
方法二:將混合氣體通入含bmolNaOH的熱溶液中,氣體恰好被完全吸收,NaOH無剩余,測得反應后溶液中含Cl
-、ClO
-、ClO
-3,根據電荷守恒可知,溶液中n(Na
+)=n(Cl
-)+n(ClO
-)+n(ClO
-3),溶液中Cl
-、ClO
-、ClO
-3三者的物質的量之比為8:1:1,據此計算各離子物質的量,根據電子轉移守恒,計算氯氣發生氧化還原反應生成的氯離子的物質的量,溶液中Cl
-來源于氯化氫及氯氣與氫氧化鈉的反應,計算反應后混合氣體中氯化氫的物質的量,根據氫元素守恒計算氫氣的物質的量.
解答:方法一:混合氣體通入含bmolNaOH的熱溶液中,氣體恰好被完全吸收,NaOH無剩余,測得反應后溶液中含Cl
-、ClO
-、ClO
-3,根據電荷守恒可知,溶液中n(Na
+)=n(Cl
-)+n(ClO
-)+n(ClO
-3),
根據氯元素守恒可知,aLH
2和Cl
2的混合氣體中n(Cl
2)=

[n(Cl
-)+n(ClO
-)+n(ClO
-3)]=

n(Na
+)=

bmol,所以aLH
2和Cl
2的混合氣體中n(H
2)=(
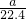
-
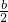
)mol
方法二:混合氣體通入含bmolNaOH的熱溶液中,氣體恰好被完全吸收,NaOH無剩余,測得反應后溶液中含Cl
-、ClO
-、ClO
-3,根據電荷守恒可知,溶液中n(Na
+)=n(Cl
-)+n(ClO
-)+n(ClO
-3),
由于溶液中Cl
-、ClO
-、ClO
-3三者的物質的量之比為8:1:1,所以溶液中n(Cl
-)=

bmol,n(ClO
-)=
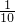
bmol,n(ClO
-3)=
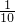
bmol,
令氯氣與氫氧化鈉反應生成的氯離子的物質的量為xmol,根據電子轉移守恒有x=
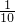
b+
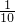
bmol×5=
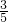
bmol,
溶液中Cl
-來源于氯化氫及氯氣與氫氧化鈉的反應,所以氯化氫提供的氯離子為

bmol-
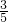
bmol=

molb,
即反應后的混合氣體中n(HCl)=

bmol,根據氫元素守恒可知,n(H
2)=

n(HCl)=

×

molb=0.1bmol,
故選:C.
點評:考查氧化還原反應的計算,難度中等,判斷溶液中n(Na
+)=n(Cl
-)+n(ClO
-)+n(ClO
-3)是解題關鍵.

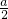 mol
mol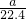 -b)mol
-b)mol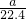 -
-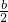 )mol
)mol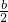 mol
mol [n(Cl-)+n(ClO-)+n(ClO-3)]=
[n(Cl-)+n(ClO-)+n(ClO-3)]= n(Na+)=
n(Na+)= bmol,所以aLH2和Cl2的混合氣體中n(H2)=(
bmol,所以aLH2和Cl2的混合氣體中n(H2)=(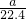 -
-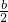 )mol
)mol bmol,n(ClO-)=
bmol,n(ClO-)=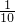 bmol,n(ClO-3)=
bmol,n(ClO-3)=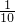 bmol,
bmol,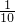 b+
b+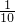 bmol×5=
bmol×5=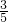 bmol,
bmol, bmol-
bmol-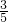 bmol=
bmol= molb,
molb, bmol,根據氫元素守恒可知,n(H2)=
bmol,根據氫元素守恒可知,n(H2)= n(HCl)=
n(HCl)= ×
× molb=0.1bmol,
molb=0.1bmol,

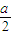 mol
mol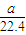 -b)mol
-b)mol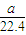 -
-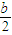 )mol
)mol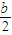 mol
mol