
【題目】反應A(g)+B(g)![]() C(g)+D(g)過程中的能量變化如下圖所示,回答下列問題。
C(g)+D(g)過程中的能量變化如下圖所示,回答下列問題。
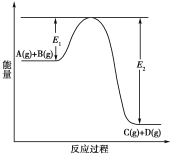
(1)該反應是________反應(填“吸熱”或“放熱”)。
(2)當反應達到平衡時,升高溫度,A的轉化率________(填“增大”、“減小”或“不變”)
(3)反應體系中加入催化劑對反應熱是否有影響?___________________________________(填“有”、或“無”)
(4)在反應體系中加入催化劑,反應速率增大,E1和E2的變化是:E1________,E2________(填“增大”、“減小”或“不變”)。
【答案】放熱減小無減小減小
【解析】
(1)由反應過程中的能量變化圖可以知道,反應物的總能量高于生成物的總能量,故反應為放熱反應,因此,本題正確答案是:放熱;
(2)該反應正反應是放熱反應,升高溫度平衡向逆反應移動,A的轉化率減小,因此,本題正確答案是:減小;
(3)加入催化劑改變了反應的途徑,降低反應所需的活化能,但催化劑不改變反應物總能量與生成物總能量之差即反應熱不變,所以對該反應的反應熱無影響;
因此,本題正確答案是:無影響;催化劑不改變反應物總能量與生成物總能量之差;
(4)加入催化劑改變了反應的途徑,降低反應所需的活化能,所以E1和E2的變化都減小,
因此,本題正確答案是:減小;減小;催化劑改變了反應的途徑,降低了反應所需的活化能;


 同步練習河南大學出版社系列答案
同步練習河南大學出版社系列答案科目:高中化學 來源: 題型:
【題目】南昌西漢海昏侯墓考古發現震驚全國,在打開內棺時,為了防止絲織品被氧化,需要充入一定的保護氣體,這種氣體是( )
A. H2 B. CO C. SO2 D. N2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵酸鹽在水溶液中有四種含鐵型體,25℃時,它們的物質的量分數隨PH的變化如圖所示。下列敘述錯誤的是
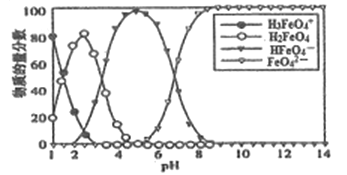
A. 已知H3FeO4+的電離平衡常數分別為:K1=2.5×10-2,K2=4.8×10-4、K3=5.0×10-8.當pH=4時,溶渡中c(HFeO4-)/c(H2FeO4)=1.2
B. 向pH=5的高鐵酸鹽溶液中加入KOH溶液,離子方程式為HFeO4-+OH-=FeO42-+H2O
C. PH=2時,溶液中主要含鐵型體濃度的大小關系為c(H2FeO4)>c(H3FeO4+)>c(HFeO4-)
D. 為獲得盡可能純凈的高鐵酸鹽,應控制PH≥9
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下列熱化學方程式:2H2(g)+O2(g)===2H2O(g);ΔH=-483.6 kJ/mol
H2(g)+![]() O2(g)===H2O(g);ΔH=-241.8 kJ/mol
O2(g)===H2O(g);ΔH=-241.8 kJ/mol
H2(g)+![]() O2(g)===H2O(l);ΔH=-285.8 kJ/mol
O2(g)===H2O(l);ΔH=-285.8 kJ/mol
則氫氣的燃燒熱為
A. 438.6 kJ/mol B. 241.8 kJ/mol C. 285.8 kJ/mol D. 無法確定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯佐卡因是局部麻醉藥,常用于手術后創傷止痛、潰瘍痛等,其結構簡式為 。下列關于苯佐卡因的敘述正確的是
。下列關于苯佐卡因的敘述正確的是
A. 分子式為C9H14NO2
B. 苯環上有2個取代基,且含有硝基的苯佐卡因的同分異構體有9種
C. 1mol該化合物最多與4mol氫氣發生加成反應
D. 分子中將氨基轉化成硝基的反應為氧化反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某KCl樣品中含有少量K2CO3、K2SO4和不溶于水的雜質。為了提純KCl,先將樣品溶于適量水中,攪拌、過濾,再將濾液按下圖所示步驟進行提純(過濾操作已略去)。下列說法正確的是

A.起始濾液常溫下pH=7 B.試劑Ⅰ為Ba(NO3)2溶液
C.上圖過程須經2次過濾 D.步驟③目的是除去CO32-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中,不正確的是 ( )
A.某特定反應的平衡常數僅是溫度的函數
B.化學平衡發生移動,平衡常數必發生變化
C.其他條件一定時,平衡常數發生變化,化學平衡必定發生移動
D.催化劑不能改變平衡常數的大小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇是最基本的有機化工原料之一。工業上可用二氧化碳和氫氣反應來生產甲醇。
(1)已知氣態甲醇的燃燒熱為a kJ/mol,2H2(g)+O2(g)= 2H2O(g) ΔH=-bkJ/mol;H2O(g)=H2O(l) ΔH= -ckJ/mol。 則CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH=_________。
CH3OH(g)+H2O(g)的ΔH=_________。
(2)某溫度下,在2 L密閉容器中,充入2.4 mol CO2和4.4 mol H2,發生合成甲醇的反應,測得甲醇的物質的量隨時間的變化圖像如下圖中的曲線I,則前4分鐘ν(CO2)=__________;若在1 min時,改變某一反應條件,曲線I變為曲線II,則改變的條件為___________;該溫度下反應的化學平衡常數為___________。
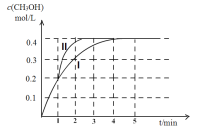
(3)在恒壓的條件下,下列選項能說明CO2+3H2![]() CH3OH+H2O反應已達平衡狀態的是______。
CH3OH+H2O反應已達平衡狀態的是______。
A、ν正(H2): ν逆(CH3OH)=3:1
B、混合氣體的密度不再變化
C、混合氣的平均摩爾質量不再變化
D、反應中H2O與CH3OH的物質的量濃度之比為1:1,且比值保持不變
(4)在另一溫度下發生合成甲醇的反應,關閉K,向A容器中充入1 mol CO2和4 mol H2,向B容器中充入1.2 mol CO2和4.8 mol H2,兩容器分別發生上述反應。已知起始時容器A和B的體積均為a L,反應達到平衡時容器B的體積為0.9a L,維持其他條件不變,若打開K一段時間后重新達到平衡,容器B的體積為______L(不考慮溫度的變化,P為可自由滑動活塞,不考慮活塞的摩擦力)。
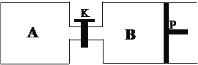
(5)一定條件下甲醇可進一步氧化轉化為甲酸。室溫下,將amol/L的甲酸與bmol/L的NaOH溶液等體積混合,體系中存在c(Na+)=c(HCOO-),試用含a和b的代數式表示甲酸的電離常數為__________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com