

| 氫氧化物 | Fe(OH)3 | Fe(OH)2 |
| 開始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
分析 以SrCO3為原料制備六水氯化鍶(SrCl2•6H2O),由流程可知,SrCO3和鹽酸發生反應:SrCO3+2HCl=SrCl2+CO2↑+H2O,反應后溶液中除含有Sr2+和Cl-外,還含有少量Fe2+、Ba2+雜質,加入過氧化氫,將Fe2+氧化為Fe3+,然后加硫酸生成硫酸鋇沉淀,同時調節溶液pH,使Fe3+轉化氫氧化鐵沉淀,所以過濾后濾渣為硫酸鋇和氫氧化鐵,濾液中含SrCl2,最后蒸發、冷卻結晶得到SrCl2•6H2O.
(1)(增大鹽酸的濃度,加熱等可以增大反應速率;碳酸鍶與鹽酸反應生成氯化鍶、二氧化碳和水;
(2)根據Fe3+開始沉淀pH與沉淀完全pH調節溶液的pH范圍,調節溶液pH使Fe3+轉化氫氧化鐵沉淀,且不能引入新雜質;
(3)SrCO3和鹽酸反應后溶液中除含有Sr2+和Cl-外,還含有少量Fe2+、Ba2+雜質,加入了稀硫酸,有硫酸鋇生成,加入過氧化氫,將Fe2+氧化為Fe3+,再調節溶液pH,水解可生成氫氧化鐵沉淀;
(4)根據六水氯化鍶晶體開始失去結晶水的溫度選擇熱風吹干時適宜的溫度;
(5)根據溶解平衡且不能引入新雜質分析解答.
解答 解:以SrCO3為原料制備六水氯化鍶(SrCl2•6H2O),由流程可知,SrCO3和鹽酸發生反應:SrCO3+2HCl=SrCl2+CO2↑+H2O,反應后溶液中除含有Sr2+和Cl-外,還含有少量Fe2+、Ba2+雜質,加入過氧化氫,將Fe2+氧化為Fe3+,加硫酸生成硫酸鋇沉淀,再調節溶液pH,使Fe3+轉化氫氧化鐵沉淀,所以過濾后濾渣為硫酸鋇和氫氧化鐵,濾液中含SrCl2,最后蒸發、冷卻結晶得到SrCl2•6H2O.
(1)增大鹽酸的濃度,加熱,或者攪拌,增大接觸面積,可以增大反應速率;
碳酸鍶與鹽酸反應生成氯化鍶、二氧化碳和水,反應的離子方程式為SrCO3+2H+=Sr2++CO2↑+H2O,
故答案為:加熱、適當增加鹽酸濃度等;SrCO3+2H+=Sr2++CO2↑+H2O;
(2)由表中數據可知,Fe3+在pH=1.5時開始沉淀,在pH=3.7時沉淀完全,故在步驟②-③的過程中,將溶液的pH值由1調節至3.7,使Fe3+轉化氫氧化鐵沉淀,且不能引入新雜質,可以選擇氫氧化鍶粉末,
故答案為:B;E;
(3)加入了稀硫酸,有硫酸鋇生成,加入過氧化氫,將Fe2+氧化為Fe3+,再調節溶液pH,水解可生成氫氧化鐵沉淀,操作③中所得濾渣的主要成分是BaSO4、Fe(OH)3,故答案為:Fe(OH)3、BaSO4;
(4)六水氯化鍶晶體61℃時開始失去結晶水,100℃時失去全部結晶水,則用熱風吹干六水氯化鍶,選擇的適宜溫度范圍是50~60℃,
故答案為:A;
(5)根據溶解平衡,且不能引入新雜質,步驟⑥宜選用的無機洗滌劑是:飽和氯化鍶溶液,
故答案為:飽和氯化鍶溶液.
點評 本題考查制備實驗方案的設計,理解制備工藝流程原理是解答的關鍵,涉及反應速率影響因素、物質的分離提純、操作條件的控制與試劑選擇等,注意對題目信息與所學知識的綜合應用,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | ①④ | B. | ①②③ | C. | ②③⑤ | D. | ③⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
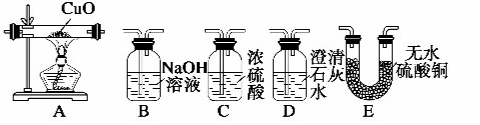
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分別點燃,有黑煙生成的是苯 | |
| B. | 分別加入溴水振蕩,靜置后分層,上、下兩層紅棕色均消失的是己烯 | |
| C. | 分別加入溴水振蕩,靜置后分層,下層紅棕色消失的是己烯 | |
| D. | 分別加入酸性高錳酸鉀溶液,振蕩,靜置后水層紫色消失的是己烯 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
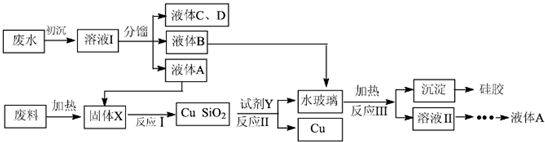
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
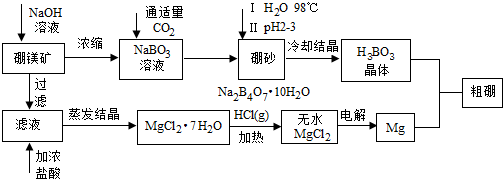
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
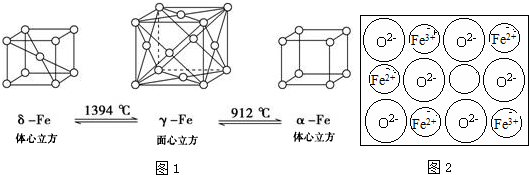
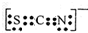 .Fe3+與SCN-可以形成配位數1~6的配離子,若Fe3+與SCN-以個數比1:5配合,則FeCl3與KSCN在水溶液中發生反應的化學方程式可以表示為FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl.
.Fe3+與SCN-可以形成配位數1~6的配離子,若Fe3+與SCN-以個數比1:5配合,則FeCl3與KSCN在水溶液中發生反應的化學方程式可以表示為FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液中水電離出的H+個數:②>① | |
| B. | ①溶液中陰離子的總濃度小于0.01 mol•L-1 | |
| C. | ②溶液中:n(OH-)=n(HCO3-)+2n(H2CO3)+n(H+) | |
| D. | ②溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com