


科目:高中化學 來源:2011-2012學年福建師大附中高二上學期期末考試化學試卷 題型:填空題
(Ⅰ)(6分)現(xiàn)有下列物質(zhì): ①NaCl晶體 ②液態(tài)SO2 ③純醋酸 ④硫酸鋇 ⑤銅 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
請用以上物質(zhì)回答下列問題。(填序號)
(1)在上述狀態(tài)下能導電的物質(zhì)是 ;
(2)屬于弱電解質(zhì)的是 ;
(3)屬于非電解質(zhì),但溶于水后的水溶液能導電的是 ;
(Ⅱ)(4分)
某化學實驗小組探究市售食用白醋中醋酸的的準確濃度,取25.00mL某品牌食用白
醋于錐形瓶中,在實驗室用濃度為cb mol/L的標準NaOH溶液對其進行滴定。
(1)左圖表示50mL滴定管中液面的位置,若A與C刻度間相差l mL,
A處的刻度為25,滴定管中液面讀數(shù)應(yīng)為 mL。
(2)為了減小實驗誤差,該同學一共進行了三次實驗,假設(shè)每次
所取白醋體積均為VmL,NaOH標準液濃度為c mo1/L,三次實
驗結(jié)果記錄如下:
| 實驗次數(shù) | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液體積/mL | 26.02 | 25.35 | 25.30 |
 H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH  H++ CH3COO- Ka=1.8×10-5
H++ CH3COO- Ka=1.8×10-5查看答案和解析>>
科目:高中化學 來源:2013屆福建師大附中高二上學期期末考試化學試卷 題型:填空題
(Ⅰ)(6分)現(xiàn)有下列物質(zhì): ①NaCl晶體 ②液態(tài)SO2 ③純醋酸 ④硫酸鋇 ⑤銅 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
請用以上物質(zhì)回答下列問題。(填序號)
(1)在上述狀態(tài)下能導電的物質(zhì)是 ;
(2)屬于弱電解質(zhì)的是 ;
(3)屬于非電解質(zhì),但溶于水后的水溶液能導電的是 ;
(Ⅱ)(4分)
某化學實驗小組探究市售食用白醋中醋酸的的準確濃度,取25.00mL某品牌食用白
醋于錐形瓶中,在實驗室用濃度為cb mol/L的標準NaOH溶液對其進行滴定。
(1)左圖表示50mL滴定管中液面的位置,若A與C刻度間相差l mL,
A處的刻度為25,滴定管中液面讀數(shù)應(yīng)為 mL。

(2)為了減小實驗誤差,該同學一共進行了三次實驗,假設(shè)每次
所取白醋體積均為VmL,NaOH標準液濃度為c mo1/L,三次實
驗結(jié)果記錄如下:
|
實驗次數(shù) |
第一次 |
第二次 |
第三次 |
|
消耗NaOH溶液體積/mL |
26.02 |
25.35 |
25.30 |
從上表可以看出,第一次實驗中記錄消耗NaOH溶液的體積明顯多于后兩次,
其原因可能是 。
A.滴定前滴定管尖嘴有氣泡,滴定結(jié)束無氣泡
B.盛裝標準液的滴定管裝液前用蒸餾水潤洗過,未用標準液潤洗
C.第一次滴定用的錐形瓶未潤洗
D.滴定結(jié)束時,俯視讀數(shù)
(3)根據(jù)所給數(shù)據(jù),寫出計算該白醋中醋酸的物質(zhì)的量濃度的表達式(不必化簡):
c= 。
(Ⅲ)(15分)
已知:在25時H2O H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH
 H++ CH3COO- Ka=1.8×10-5
H++ CH3COO- Ka=1.8×10-5
(1)取適量醋酸溶液,加入少量醋酸鈉固體,此時溶液中C(H+)與C(CH3COOH)
的比值 (填“增大”或“減小”或“不變”)
(2)醋酸鈉水解的離子方程式為 。當升高溫度時,C(OH—)將
(填“增大”“減小”“不變”);
(3)0.5mol·L-1醋酸鈉溶液pH為m,其水解的程度(已水解的醋酸鈉與原有醋酸鈉
的比值)為a;1mol·L-1醋酸鈉溶液pH為n,水解的程度為b,則m與n的關(guān)系
為 ,a與b的關(guān)系為 (填“大于”“小于”“等于”);
(4)將等體積等濃度的醋酸和氫氧化鈉溶液混合后,所得溶液中離子濃度由大到小的順序是 。
(5)若醋酸和氫氧化鈉溶液混合后pH<7,則c(Na+)_______________ c(CH3COO-)(填“大于”、“小于”或“等于”),
(6)若由pH=3的HA溶液V1mL與pH=11的NaOH{溶液V2 mL。混合而得,則下列說法不正確的是____________。
A.若反應(yīng)后溶液呈中性,則c(H+)+c(OH-)=2×10-7mol·L-1
B.若V1=V2,反應(yīng)后溶液pH一定等于7
C.若反應(yīng)后溶液呈酸性,則V1一定大于V2
D.若反應(yīng)后溶液呈堿性,則V1一定小于V2
(7)在某溶液中含Mg2+、Cd2+、Zn2+三種離子的濃度均為0.01mol·L-1。向其中加入固
體醋酸鈉后測得溶液的C(OH-)為2.2×10-5mol·L-1,以上三種金屬離子中
能生成沉淀,原因是
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL0.5mol·L-1鹽酸溶液,加水稀釋到500mL,則該溶液中由水電離出的c(H+)
= 。
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
(17分)化學在能源開發(fā)與利用中起著十分關(guān)鍵的作用。
(1)蘊藏在海底的“可燃冰”是高壓下形成的外觀象冰的甲烷水合物固體。甲烷氣體燃燒和水汽化的熱化學方程式為:
CH4(g)+2O?2(g)=CO2(g)+2H2O(g)△H=-802.3kJ?mol-1
H2O(l)=H2O(g) △H=+44kJ?mol-1
則356g“可燃冰”(分子式為CH4?9H2O)釋放的甲烷氣體完全燃燒生成液態(tài)水,放出的熱量為 。
(2)熔融鹽燃料電池具有很高的發(fā)電效率,因而受到重視,可用Li2CO3和Na2CO3的熔融鹽混合物作電解質(zhì),CO為負極燃氣,空氣與CO2的混合氣體為正極助燃氣,制得在650℃下工作的燃料電池,完成有關(guān)的電池反應(yīng)式:正極反應(yīng)式:
O2+2CO2+4e-=2CO2-3,負極反應(yīng)式 。
(3)已知一氧化碳與水蒸氣的反應(yīng)為:
CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
①T℃時,在一定體積的容器中,通入一定量的CO(g)和H2O(g),發(fā)生反應(yīng)并保持溫度不變,各物質(zhì)濃度隨時間變化如下表:
T℃時物質(zhì)的濃度(mol/L)變化
時間/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | 0.100 | 0.200 | 0.100 | 0.100 |
4 | 0.100 | 0.200 | 0.100 | 0.100 |
5 | 0.116 | 0.216 | 0.084 | c1 |
6 | 0.096 | 0.266 | 0.104 | c2 |
第5、6min時的數(shù)據(jù)是保持溫度和體積不變時,改變某一條件后測得的。第4~5min之間,改變的條件是 。T℃時該化學反應(yīng)的平衡常數(shù)是 。
②已知420℃時,該化學反應(yīng)的平衡常數(shù)為9,如果反應(yīng)開始時,CO(g)和H2O(g)的濃度都是0.01mol/L,則CO在此條件下的轉(zhuǎn)化率為 。
③397℃時,該反應(yīng)的化學平衡常數(shù)為12,請判斷該反應(yīng)的△H 0(填“>、=、<”)。
(4)燃料電池中產(chǎn)生的CO2氣體可以用堿液吸水得到Na2CO3和NaHCO3。常溫下向20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/HCl溶液40mL,溶液中含碳元素的各種微粒(CO2因逸出未畫出)物質(zhì)的量分數(shù)(縱軸)隨溶液pH變化的部分情況如下圖所示。根據(jù)圖象回答下列問題:

①在同一溶液中,H2CO3、HCO-3、CO2-3(填:“能”或“不能”) 大量共存。②當pH=7時溶液中含碳元素的主要微粒為 ,此時溶液中c(HCO-3) c(Na+)(填“>、=、<”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
廣東省有著豐富的海洋資源。海水提取食鹽和Br2以后的鹽鹵可以用來制備純凈的MgCl2或MgO。鹽鹵中含有Mg2+、Cl-,還含有少量Na+、Fe2+、Fe3+、SO42-和CO(NH2)2等。制備流程如下圖:
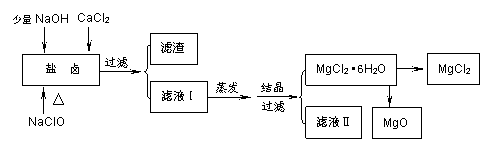
(1)濾渣的成分是 (寫化學式);濾液Ⅱ中所含主要的雜質(zhì)離子是 (寫離子符號)。
(2)用NaClO除去尿素CO(NH2)2時,生成物除鹽外,都是能參與大氣循環(huán)的物質(zhì),則該反應(yīng)的化學方程式為 ;加入NaClO的另一個作用是 。
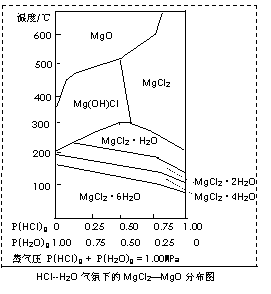
(3)溫度和壓強P(HCl)g對MgCl2?6H2O晶體熱分解產(chǎn)物的影響如圖所示。請回答下列問題:
①寫出P(HCl)g = 0.25MPa,溫度從300℃升高到550℃時反應(yīng)的化學方程式 ;
②實際生產(chǎn)中,將MgCl2?6H2O晶體加熱到600℃的過程中幾乎得不到無水MgCl2,其原因是 ;若要得到無水MgCl2須采取的措施是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
下表是A、B、C、D、E五種有機物的有關(guān)信息;
A | B | C | D | E |
①能使溴的四氯化碳溶液褪色;
③能與水在一定條件下反應(yīng)生成C | ①由C、H兩種元素組成; ②球棍模型為:
| ①由C、H、O三種元素組成; ②能與Na反應(yīng),但不能與NaOH溶液反應(yīng)。 | ①相對分子質(zhì)量比C少2; ②能由C氧化而成; | ①由C、H、O三種元素組成; ②球棍模型為:
|
根據(jù)表中信息回答下列問題:
(1)A與溴的四氯化碳溶液反應(yīng)的生成物的名稱叫做 ;寫出在一定條件下,A生成高分子化合物的化學反應(yīng)方程式__ _____。
(2) A與氫氣發(fā)生加成反應(yīng)后生成分子F,F(xiàn)在分子組成和結(jié)構(gòu)上相似的有機物有一大類(俗稱“同系物”),它們均符合通式CnH2n+2。當n=__________時,這類有機物開始出現(xiàn)同分異構(gòu)體。
(3) B具有的性質(zhì)是 (填號):①無色無味液體、②有毒、③不溶于水、④密度比水大、⑤與酸性KMnO4溶液和溴水反應(yīng)褪色、⑥任何條件下不與氫氣反應(yīng);寫出在濃硫酸作用下,B與濃硝酸反應(yīng)的化學方程式: 。
(4) E反應(yīng)能生成(C3H4O2)n的物質(zhì),該反應(yīng)類型為 ;工業(yè)生產(chǎn)中使用鎳作催化劑。但要求原料中含硫量小于5×10![]() %,其目的是 。
%,其目的是 。
(5) 寫出由C氧化生成D的化學反應(yīng)方程式: 。
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com