
| A. | H2O2在①中是氧化劑,在②中是還原劑 | |
| B. | Mn2+在①中是還原產物,在②中是氧化產物 | |
| C. | 在①中每生成1 mol O2,轉移的電子數為2.408×1024 | |
| D. | 在二氧化錳催化作用下1 mol H2O2分解生成0.5 mol O2 |
分析 ①MnO2+H2O2+2H+=Mn2++O2↑+2H2O中,Mn元素的化合價降低,過氧化氫中O元素的化合價升高;
②Mn2++H2O2=MnO2+2H+中,Mn元素的化合價升高,O元素的化合價降低,以此來解答.
解答 解:①MnO2+H2O2+2H+=Mn2++O2↑+2H2O中,Mn元素的化合價降低,過氧化氫中O元素的化合價升高;
②Mn2++H2O2=MnO2+2H+中,Mn元素的化合價升高,O元素的化合價降低,
A.H2O2在①中是還原劑,在②中是氧化劑,故A錯誤;
B.Mn2+在①中是還原產物,在②中是還原劑,故B錯誤;
C.由元素的化合價升降可知,在①中每生成1 molO2,轉移1mol×2×(1-0)=2mo電子l,轉移的電子數為1.204×1024,故C錯誤;
D.反應①+②可得2H2O2=2H2O+O2↑,在二氧化錳催化作用下,1 mol H2O2分解生成0.5molO2,故D正確;
故選D.
點評 本題考查氧化還原反應,為高頻考點,明確反應中元素的化合價升降是解答的關鍵,側重基本概念和轉移電子數的考查,選項D為解答的易錯點,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 鋁合金的密度小,硬度大,可用作建筑材料 | |
| B. | 銅、鋁、鈉可以分別用熱還原法、熱分解法和電解冶煉 | |
| C. | 電解從海水中得到的氯化鎂溶液可獲得金屬鎂 | |
| D. | 工業上用鋁熱反應來冶煉鐵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=1的溶液中:Fe3+、NO3-、SO42-、Na+ | |
| B. | 使酚酞變紅色的溶液中:Na+、Al3+、HCO3-、NO3- | |
| C. | 能與金屬鋁反應生成氫氣的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 無色透明的溶液中:K+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶劑的質量為:(dV-0.208Vc)g | |
| B. | 溶質的質量分數為:$\frac{208c}p9vv5xb5$% | |
| C. | 溶質和溶劑的質量之比為:0.208Vc:(dV-0.208Vc) | |
| D. | Cl-的物質的量為:0.002Vc mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
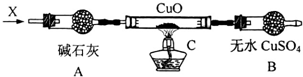 銅是常見的變價金屬.為了比較正一價銅和正二價銅的穩定性,并研究氧化銅的氧化性,某化學小組的同學進行了以下實驗.
銅是常見的變價金屬.為了比較正一價銅和正二價銅的穩定性,并研究氧化銅的氧化性,某化學小組的同學進行了以下實驗.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用CO2合成聚碳酸酯等可降解塑料,減少白色污染 | |
| B. | 推廣燃煤發電,停建核電站,避免核泄漏事故的危害 | |
| C. | 加強生活污水的脫氮除磷處理,遏制水體的富營養化 | |
| D. | 實施化石燃料脫硫脫硝技術,減少大氣污染物的排放 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | B電極發生還原反應 | |
| B. | A電極上發生的一個電極反應為:2Li++S8+2e-═Li2S8 | |
| C. | 每生成1mol Li2S8轉移0.25mol電子 | |
| D. | 電子從B電極經過外電路流向A電極,再經過電解質流回B電極 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2在大氣中能最終生成H2SO4:2SO2+O2+2H2O═4H++2SO42- | |
| B. | 少量SO2與NaOH溶液反應的離子方程式是:SO2+OH-═HSO3- | |
| C. | NaOH溶液緩慢吸收過量SO2的過程中有:SO2+SO32-+H2O═2HSO3- | |
| D. | n(SO2):n(NaOH)=1:2時,溶液pH>7:SO32-+H2O?HSO3-+OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 生成物總能量一定低于反應物總能量 | |
| B. | △H的大小與熱化學方程式的計量系數無關 | |
| C. | 應用蓋斯定律可計算某些難以直接測量的反應燴變 | |
| D. | 同溫同壓下,H2(g)十Cl2(g)=2HC1(g)在光照和點燃條件下的△H不同 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com